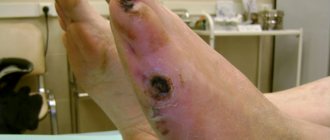
Реперфузионный синдром — это собирательное понятие, которое объединяет различные патоморфологические состояния, развивающиеся после восстановления кровообращения в различных тканях органа или сегменте конечности, длительное время находившихся в состоянии ишемии или травматической ампутации [1]. Тяжесть повреждений ишемизированных тканей после их реперфузии зависит от толерантности этих тканей к аноксии и продолжительности первичной ишемии. Аноксическая толерантность свободных мышечных лоскутов, т.е. устойчивость скелетной мускулатуры к кислородному голоданию без тяжелых патоморфологических последствий, всего 2 ч, тогда как кожно-фасциальных лоскутов — 4 ч. Синдром ишемии/реперфузии наиболее ярко проявляет себя в свободных мышечных и кожно-мышечных лоскутах, содержащих скелетные мышцы, а также в крупных реплантатах конечностей. В первую очередь он проявляет себя в энергонеустойчивых скелетных мышцах. Восстановление доставки кислорода к ишемизированным тканям запускает процесс продукции активированных форм кислорода — свободных радикалов (супероксидных радикалов кислорода), продуктов перекисного окисления липидов. Этот процесс носит взрывной характер, который приводит к разрушению клеточных мембран в реперфузируемых тканях. В аноксически малотолерантной скелетной мышце развивается энергетическая недостаточность поперечно-полосатых мышечных волокон. Она обусловлена превращением АТФ в митохондриях ишемизированных мышечных волокон в АМФ с последующим образованием аденозина, инозина, гипоксантина. Накапливаются кислые промежуточные продукты анаэробного метаболизма — лактат, пируват, глицерол. Среди них, например, лактаты, вызывающие спазм прекапиллярных сфинктеров [1—3]. В присутствии ксантиноксидазы кислород преобразует гипоксантин в ураты [4]. Другими словами, ранее голодавшие от недостатка кислорода ткани после реперфузии жадно поглощают его, образуя огромное количество перекисных соединений, с которыми не могут справиться антиоксидантные системы. Резко усиливается перекисное окисление липидов, что приводит к прямому повреждению клеточных мембран и свободнорадикальному некробиозу [5]. А.Е. Белоусов (1998) классифицировал реперфузионный синдром в свободных лоскутах и в крупных реплантатах конечностей на три степени тяжести: компенсированную, субкомпенсированную и декомпенсированную (необратимую) [6]. В мышечных (скелетных) лоскутах и в крупных реплантатах конечностей необратимые изменения (декомпенсированный реперфузионный синдром) наступают после 3-часовой острой ишемии [7]. Реперфузионные расстройства в кожно-мышечных и кожно-мышечно-костных лоскутах клинически проявляются в 5—20% случаев различными вариантами нарушений периферической гемодинамики — преходящими либо постоянными (продолжительными), приводящими к их гибели. Преходящие нарушения, т.е. после небольшой продолжительности первичной ишемии (до 1 ч), проявляются гиперемией кожи лоскута и метаболическим отеком тканей, которые через 10—40 мин после реперфузии исчезают (компенсированный реперфузионный синдром). В экспериментальных условиях на кроликах было показано, что временная (4-часовая) перевязка сосудистой ножки несвободных эпигастральных кожно-фасциальных лоскутов в 80% случаев завершалась выживанием после снятия лигатур [8]. Кожа в составе кожно-фасциального лоскута легко переживает 4-часовую первичную ишемию, что значительно превышает по времени продолжительность выполнения двух микрососудистых анастомозов (первичной ишемии). Что касается высокой ишемической устойчивости свободных кожно-фасциальных лоскутов, то apriori считается, что в них синдром ишемии/реперфузии никак себя не проявляет. Эти представления вызывают у нас большие сомнения. Синдром ишемии/реперфузии в аноксически устойчивой коже не может не оставить следов, например в ее сосудистом русле с малоустойчивым к аноксии эндотелием и нарушенным механизмом ауторегуляции микроциркуляции. Данные обстоятельства стали основанием для экспериментального исследования по изучению влияния ишемии/реперфузии на морфофункциональные параметры сосудов в коже (дерме и эпидерме) реперфузируемых кожно-фасциальных лоскутов и особенности их приживления в реципиентном ложе.
Цель исследования — сравнительное изучение реакции сосудов в кожно-фасциальных лоскутах после полной хирургической денервации и периода первичной ишемии.
Задачи исследования:
1. Изучить анатомию сосудов кожи в пределах разметки эпигастрального лоскута (без его подъема).
2. Оценить состояние сосудов кожи несвободного эпигастрального лоскута после его полной хирургической денервации, а также приживление денервированного лоскута на фоне сосудистых расстройств.
3. Оценить состояние сосудов кожи и приживление реперфузируемого свободного эпигастрального лоскута после 60—90-минутной ишемии.
Какие имеются варианты реперфузии миокарда?
Известно, что процесс полного или частичного восстановления кровотока в ишемизированной зоне миокарда может происходить спонтанно или искусственным путем [2, 3, 7].
Спонтанная реперфузия может развиваться вследствие лизиса либо реканализации коронарного тромба, прекращения спазма коронарной артерии, усиления коллатерального кровотока в участке ишемии.
Искусственная реперфузия достигается с помощью внутрикоронарного или внутривенного введения тромболитических агентов, а также хирургических методов (перкутанная транслюминальная коронарная ангиопластика (ПТКА), аортокоронарное шунтирование и др.) [5, 25, 39, 49]. Однако, несмотря на дифференцированный механизм, возобновление кровотока в окклюзированной артерии вызывает ряд процессов, объединенных в термин «реперфузионное повреждение миокарда», которые негативно влияют на восстановление функции ишемизированного миокарда [1, 3, 9, 43].
Материал и методы
Выбор экспериментальной модели основан на ее универсальности в плане моделирования разнообразных вариантов пересадки лоскутов у экспериментальных животных.
Выполнено три серии экспериментальных исследований (n=53):
1. Изучение анатомии сосудов кожи в пределах разметки эпигастрального кожно-фасциального лоскута (n=3).
2. Операция транспозиции осевого эпигастрального кожно-фасциального лоскута после его полной хирургической денервации (периадвентициальной симпатэктомии сосудистой ножки на протяжении 0,5—0,7 см) и изоляции лоскута от окружающих тканей (n=25).
3. Операция реплантации свободного эпигастрального лоскута у крыс по P.G. van der Sloot (2002) (n=25) [9].
С целью изучения реакции сосудистого русла кожи эпигастральной области крыс использовали способ инъекции в сосудистое русло синей массы Героты. Далее выполняли просветление полученных препаратов по способу В. Шпальтегольца (1921) в модификации Д.А. Жданова (1943), после чего производили препаровку и изготовление микроанатомических препаратов. Реакцию сосудистого русла эпигастральных лоскутов исследовали под микроскопом Carl Zeiss Opmi Pro (ув. ×32). Подсчет численной плотности артериальных и венозных сосудов выполняли по препаратам, взятым от двух животных для каждой контрольной точки. Подсчет проводился в 5 полях зрения каждого препарата с пересчетом количества сосудов на 1 мм2. При морфометрии сосудов артериального и венозного русла лоскута измеряли диаметр просвета сосуда (см).
Функциональное состояние периферического сосудистого русла лоскутов оценивали в динамике по цвету кожи лоскута, симптому исчезающего пятна (капиллярный ответ) и контактному кровотечению. Состояние волосяного покрова лоскута в динамике и тип формирующегося кожного рубца (нормотрофический, гипертрофический, атрофический) характеризовали его кровоснабжение и процесс приживления в реципиентном ложе.
Статистическую обработку полученных результатов проводили с помощью программ Statistica 7.0 for Windows и SPSS Statistics 17.0 (коэффициент корреляции Спирмена). Достоверность различий качественных признаков определяли с помощью точного критерия Фишера [10].
Какие известны проявления реперфузионного повреждения миокарда?
Реперфузионное повреждение миокарда может проявляться в виде:
— реперфузионных аритмий (РА), которые представлены желудочковой экстрасистолией, ускоренным идиовентрикулярным ритмом (УИР), желудочковой тахикардией (ЖТ) и фибрилляцией желудочков (ФЖ) [14, 26, 28, 32, 53];
— феномена «оглушения» миокарда (stunning myocardium), то есть его обратимой постишемической дисфункции [12, 17, 44, 48];
— повреждения сосудов микроциркуляторного русла и отсутствия восстановления коронарного кровотока на уровне тканей (феномен no-reflow) [31, 33, 47];
— ускоренного развития некроза кардиомиоцитов (КМЦ), функция которых была нарушена предшествующей ишемией [1, 43].
Наибольшую проблему представляют РА, так как до сих пор не выяснены механизмы их возникновения и необходимость их лечения.
Аритмии, индуцированные реперфузией, обычно возникают сразу после восстановления проходимости сосуда как следствие резких клеточных, метаболических и локальных электрофизиологических изменений [2, 3, 42, 51].
Какие известны механизмы реперфузионного повреждения миокарда?
В основе развития реперфузионного повреждения миокарда, следовательно, и РА лежат следующие механизмы, которые дополняют друг друга и взаимосвязаны:
— неблагоприятные эффекты реоксигенации ишемизированной ткани с образованием свободных радикалов кислорода («кислородный парадокс») [1, 8, 11, 15];
— избыточное поступление ионов кальция (Са2+) из экстрацеллюлярного пространства внутрь КМЦ с последующим нарушением функции митохондрий, снижением продукции аденозинтрифосфата (АТФ), образованием контрактуры кардиомиоцитов и в последующем их гибелью («кальциевый парадокс») [12, 18, 51];
— механическое повреждение КМЦ во время восстановления кровотока [8, 22, 43].
Положительное влияние кислорода на функциональное состояние сердца в раннем периоде ИМ (инфаркта миокарда) во многом обусловлено уменьшением размера зоны ишемии и сохранением большего количества КМЦ, способных к эффективному сокращению [6, 9, 15, 35]. С другой стороны, реоксигенация является важным фактором, способствующим развитию аритмий [2, 31, 36, 47].
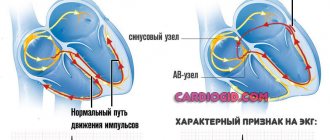
При образовании гидроксильного радикала (ОН–), являющегося сильным окислителем и запускающего процессы перекисного окисления липидов (ПОЛ) в биомембранах кардиомиоцитов [2, 5, 8, 15], было установлено, что под его воздействием причиной возникновения брадиаритмий и последующей остановки сердца является не повреждение сократительного миокарда и асистолия, а повреждение синусового узла и депрессия генерации в нем импульсов, то есть нарушение функции автоматизма [15].
При электрофизиологических исследованиях установлено, что повышение уровня свободных радикалов приводит к аритмогенным изменениям характеристик потенциала действия, нарушениям различных фаз деполяризации и увеличению автоматизма, которое проявляется в виде нарушений ритма [10, 14, 15, 41].
Большое внимание в развитии реперфузионного повреждения отводится активированным полиморфноядерным лейкоцитам, которые способны продуцировать большое количество супероксидных анионов и являются источником протеиназ, в частности эластазы, коллагеназы и липооксигеназы, секретирующихся во внеклеточную среду при дегрануляции и обладающих мощным альтеративным действием на клеточные мембраны [1, 8, 9, 29, 48]. Также они способствуют высвобождению биологически активных веществ (тромбоксан, лейкотриены, активизирующий тромбоцитарный фактор), которые участвуют в локальной реакции воспаления [15, 31]. Кроме того, значение нейтрофилов в патогенезе реперфузионного повреждения миокарда обусловлено их способностью закупоривать капилляры в зоне ишемии/реперфузии, что лежит в основе феномена no-reflow [21, 24, 33].
Не менее значимым механизмом реперфузионного повреждения миокарда является ранняя перегрузка клеток кальцием [18, 20, 22, 46]. Содержание кальция в цитоплазме КМЦ повышается еще в период ишемии вследствие нарушения функции К+/Nа+-Са2+-насосов и Nа+/Са2+-обменного механизма в условиях дефицита АТФ. Сразу же после реперфузии происходит ресинтез АТФ, что делает возможным возобновление обратного захвата Са2+ саркоплазматическим ретикулумом и его «перекачивание» во внеклеточную среду. Поскольку к этому времени концентрация Са2+ в цитоплазме клеток оказывается значительно повышенной, амплитуда кальциевых токов резко увеличивается, что создает условия для возникновения РА [1, 9, 14, 51].
При ишемии/реперфузии вследствие избытка свободных радикалов кислорода наблюдается повреждение сосудов микроциркуляторного русла во многих органах, включая сердце, что приводит к возникновению феномена no-reflow [10, 24, 33]. По данным ряда авторов, во время восстановления кровотока снижение коронарной перфузии приводит к возникновению аритмий и постишемической сократительной дисфункции (stunning myocardium) [12, 17, 44]. Это может подтверждаться тем, что при использовании скавенджеров свободных радикалов и вазодилататоров (нитропруссид натрия, дипиридамол) [15, 23] не происходит повышения перфузионного давления в коронарных артериях, наблюдается быстрое восстановление потенциала действия, что способствует восстановлению сократительной способности миокарда и уменьшению частоты развития аритмий [10, 14, 42].
Существует мнение о действии на начальном этапе восстановления кровотока дополнительного (механического) фактора повреждения мембран КМЦ в связи с их перерастяжением и разрывами [8, 9, 19, 22].
Вышеизложенные изменения наряду с ишемией и некрозом клеток вследствие ОИМ способствуют формированию аритмогенного субстрата, который, по современным представлениям, является зоной электрической нестабильности и характеризуется нарушением нормальных физиологических соотношений между скоростью проведения импульса и длительностью рефрактерного периода в соседствующих группах миоцитов. Это обусловливает локальные нарушения проводимости, рефрактерности и автоматизма, что приводит к формированию электрической негомогенности миокарда желудочков [3, 4, 14, 42].
Развитие ОИМ сопровождается значительной активацией симпатоадреналовой системы и выбросом катехоламинов, которые участвуют в развитии процессов ишемии/реперфузии. Их воздействие приводит к дестабилизации липидного обмена в КМЦ, активируя процессы ПОЛ, нарушению регуляции тонуса сосудистого русла, изменяя микроциркуляцию миокарда и участвуя тем самым в развитии феномена no-reflow. Кроме того, катехоламины оказывают непосредственное влияние на электрофизиологические параметры миокарда, активизируя эктопический автоматизм и триггерный механизм инициирования желудочковых аритмий, а также способствуют формированию петли re-entry и запуску ЖТ и ФЖ [3, 4, 11, 42]. Вышеизложенное объясняет возможность применения блокаторов адренергических структур для предупреждения развития реперфузионных осложнений [3, 42].
Реперфузионный синдром, методы профилактики и лечения вторичного повреждения тканей при ишемии
Актуальность. Критические состояния, травмы, многие заболевания и ранний послеоперационный период часто сопровождаются ишемией тканей и органов. Возникающие расстройства кровообращения могут проявляться клинически значимыми симптомами (гипотонией, тахикардией), а также протекать без видимых клинических проявлений. Чаще всего эти нарушения происходят на уровне микроциркуляции, быстротечны и проходят бесследно, однако при тяжелых критических состояниях кровообращение нарушается и в регионарных бассейнах системы кровоснабжения, что приводит к развитию органной или полиорганной недостаточности. Лечение больных в этот период чрезвычайно сложно, требует больших усилий и затрат.
В клинической практике врач довольно часто встречается с различными проявлениями ишемии тканей, которая может быть как кратковременной, так и длительной, локальной или распространенной. В зависимости от этого итогом ишемии может быть полное восстановление функции и структуры, или некроз и анатомический дефицит.
Основной задачей клинициста в этих случаях становится восстановление макро— и микроциркуляции. Между тем, парадокс лечения заключается в том, что при восстановлении кровообращения в ишемизированных тканях, доставка кислорода сопровождается образованием его активных форм, которые повреждают мембраны клеток [9, 15]. В результате этого возникает вторичное повреждение тканей и органов, развивается реперфузионный синдром. Благо превращается во вред. Степень выраженности данного синдрома определяется распространенностью и длительностью ишемии, предшествовавшей восстановлению кровообращения.
Реперфузионный синдром – это комплекс клинических проявлений восстановления кровообращения в ранее ишемизированных тканях, сопровождающийся повреждением клеток, тканей и органов на местном и системном уровне с развитием полиорганной недостаточности.
Этот синдром является универсальным ответом организма на ишемию любой этиологии.
Клинические состояния, при которых развивается реперфузионный синдром
В медицинской практике давно отмечено, что при некоторых состояниях на фоне улучшения показателей гемодинамики отмечается ухудшение общего состояния. Известен факт, что после черепно—мозговой травмы (ЧМТ) и относительной стабилизации гемодинамики с началом лечения состояние пострадавших ухудшается, нарастает степень угнетения сознания [2, 3, 5]. Нейрохирурги и реаниматологи давно ищут пути профилактики этого вторичного повреждения головного мозга при тяжелой ЧМТ.
Описан также синдром включения у пациентов после восстановительных операций при окклюзионных поражениях сосудов нижних конечностей, когда возникают нарушения функции почек, коронарного кровоснабжения, дыхательные расстройства по типу острого респираторного дистресс—синдрома (ОРДС) [3]. Пик этих проявлений отмечается через сутки от начала лечения.
Яркую клиническую картину синдрома включения отмечали при использовании перфторана у больных с синдромом Лериша. Улучшение периферического кровообращения (потепление конечности) сопровождалось выраженными болями в пояснице, повышением уровня азотистых шлаков и молекул средней массы, ацидозом, нарушениями сердечного ритма, снижением индекса оксигенации, развитием острого повреждения легких.
При восстановлении кровообращения в коронарных сосудах при инфаркте миокарда после выполненной баллонной ангиопластики, стентирования или тромболизиса часто возникают нарушения сердечного ритма, которые трудно поддаются лечению, а эффективных методов профилактики этих аритмий до настоящего времени не предложено [4, 6, 9]. Реперфузионный синдром при экспериментальном инфаркте миокарда был впервые описан в 1960 году [14]. Авторы описали признаки повреждения миокарда: клеточный отек, контрактуру миофибрилл, разрывы сарколеммы и повреждения митохондрий. На сегодняшний день с реперфузионными повреждениями миокарда связывают осложнения операций по восстановлению кровотока в инфаркт—зависимой артерии [9, 10, 11, 13].
Тяжелые сочетанные травмы, расширенные и комбинированные оперативные вмешательства, массивные кровопотери, интоксикации и другие состояния сопровождаются централизацией кровообращения. Важной составляющей лечения таких пациентов является восстановление кровообращения в системе микроциркуляции. При этом основная задача – доставить кислород к тканям, где его недостаточно. Доставка кислорода в ишемизированные ткани сопровождается развитием оксидативного каскада. В восстановлении кровообращения в системе микроциркуляции и регуляции капиллярного кровотока важную роль играет серотонин [1, 7].
Значительные поражения тканей в период восстановления кровообращения клинически сопровождаются местными и общими нарушениями. Так, местно, при реперфузии мозга, увеличивается отек, клинически нарастает неврологический дефицит; в оперированной конечности появляются боли, нарастают трофические расстройства; изменения в сердце приводят к нарушениям ритма. Системным проявлением реперфузионного синдрома является развитие полиорганной недостаточности. Чаще всего при этом нарастают явления ОРДС, почечной недостаточности и энцефалопатии.
Таким образом, реперфузионный синдром развивается в том месте, где был эпизод ишемии с последующим восстановлением кровообращения и доставки кислорода [8]. Чем большая длительность и обширность ишемии, тем более выражены симптомы реперфузии.
Патогенез реперфузионного синдрома
В критических ситуациях, сопровождающихся расстройствами кровообращения, от гипоксии страдают большие объемы тканей. Биохимическая «буря» приводит к катастрофическому росту соответствующих маркеров ишемии, повышению уровня лактата. Кислые продукты вызывают спазм прекапиллярных сфинктеров. При ишемии длительностью более 2—х часов наступает гибель большинства клеток, страдают анатомические структуры, развивается органная недостаточность. У данной категории больных чаще развиваются почечная, дыхательная и сердечная недостаточности.
При шунтировании крови метаболизм становится на путь анаэробного гликолиза, возникает энергетическая недостаточность клеток. Накапливаются кислые промежуточные продукты обмена веществ. При восстановлении кровообращения и доставки кислорода тканям активируется процесс окисления, что ведет к вторичному повреждению мембран клеток активными кислородными радикалами (Рис. 1). Количество их возрастает в геометрической прогрессии.
В ходе ишемии АТФ превращается в АМФ, затем следует образование аденозина, инозина, гипоксантина. Основная продукция активных форм кислорода (АФК), повреждающих ткани, наступает при реперфузии, когда в присутствии ксантиноксидазы кислород преобразует гипоксантин в ураты и образуются активные радикалы. АФК разрушают клеточные мембраны, это приводит к дальнейшему ухудшению состояния тканей [3, 5, 15]. Так возникает вторичное повреждение тканей (рис. 2).
Лечение и профилактика реперфузионного синдрома
Основные цели лечения данных состояний направлены на восстановление кровоснабжения, доставку кислорода тканям и перфузию в системе микроциркуляции. Это достигается путем восполнения объема циркулирующей крови (ОЦК), глобулярного объема, снижения вязкости крови и улучшения микроциркуляции в зонах нарушенного кровообращения, путем применения различных групп лекарственных средств, включая прямые антикоагулянты, периферические вазодилататоры (преимущественно блокаторы медленных кальциевых каналов), пентоксифиллин (трентал), серотонин, миотропные спазмолитики (папаверин) и др. [7, 10, 12]. Папаверин оказывает терапевтический эффект и в кислой среде, снимает спазм сосудов даже после снятия длительно наложенного жгута.
В последние годы весьма перспективно применение серотонина, который по данным ультразвуковой допплерографии увеличивает объемную систолическую (Qas) и среднюю (Qam) скорость капиллярного кровотока до 20 раз, уменьшая тем самым переходные зоны ишемии (Врублевский О. Ю. с соавт. , 1997). Этот эффект серотонина позволяет назначать его больным с инфарктом миокарда, ишемическим инсультом, при синдроме диабетической стопы, ОРДС.
Чем лучше восстанавливается кровообращение в тканях и повышается доставка кислорода, тем больше образуется АФК и наиболее выраженным становится вторичное повреждение. Для коррекции таких состояний были предложения уменьшать доставку кислорода к поврежденным тканям, но это не выход из сложившейся ситуации. Для нейтрализации АФК в последнее время стали широко применять антиоксиданты (рис. 3). Наиболее часто из препаратов данной группы используют мексидол, который существенно снижает выраженность оксидативного стресса. Тем не менее, следует понимать, что его воздействие направлено на субстраты, которые уже образовались в зонах устранения ишемии. С этой же целью применяются и другие антирадикальные средства: препараты супероксиддисмутазы, витамин Е, Витамин А, Витамин С и др.
Супероксиддисмутаза (СОД) является катализатором обратной реакции – дисмутации (обратного превращения) АФК в кислород и перекись водорода. СОД работает вместе с каталазой, которая расщепляет Н2О2 на молекулярный кислород и воду. В связи с этим в комплекс терапии реперфузионного синдрома следует включать препараты супероксиддисмутазы (Орготеин, Рексод и др. ).
Патогенетически наиболее эффективным средством лечения реперфузионного синдрома должен стать препарат, способный препятствовать образованию активных кислородных радикалов. Этим можно предотвратить образование АФК и тем самым вторичное повреждение мембран клеток, что и будет профилактикой реперфузионного синдрома.
Данными фармакологическими свойствами характеризуется препарат аллопуринол, который обладает специфической способностью ингибировать фермент ксантиноксидазу, который принимает участие в превращении гипоксантина в ксантин. В ходе данной реакции также запускается процесс активного образования АФК [6, 15]. Ингибируя ксантиноксидазу, аллопуринол предотвращает образование активных форм кислорода, и, являясь по сути прооксидантом, защищает ткани от химически активных воздействий. С этой целью следует применять таблетки аллопуринола внутрь (парентеральных форм аллопуринола в настоящее время на фармацевтическом рынке не представлено), через желудочный или интестинальный зонд после измельчения, растворив в воде. Доза составляет 300—500 мг в сутки. Назначается после восстановления всасывающей функции кишечника. Также аллопуринол может назначаться внутрь за 2—3 часа перед большими травмирующими оперативными вмешательствами, перед предстоящим тромболизисом или баллонной ангиопластикой, перед восстановлением кровообращения в конечностях.
В комплексе терапии тяжелых состояний следует применять и другие антиоксиданты, которые значительно улучшают результаты лечения. Антиоксиданты гасят «костер» оксидативного стресса, а аллопуринол не дает ему разгореться.
Таким образом, включение аллопуринола в комплекс интенсивной терапии тяжелых состояний позволит предотвратить реперфузионные повреждения клеток и тканей, развитие органной и полиорганной недостаточности. Применение аллопуринола для профилактики реперфузионного синдрома должно поставить эффективность интенсивной терапии на ступень выше и дать хороший клинический и экономический эффект.
Профилактика реперфузионного синдрома исключает образование АФК, обеспечивая поступление О2 сразу в клетку, восстанавливает аэробный путь обмена веществ и повышает его энергетическую ценность, что позволяет защитить ткани и органы от вторичного повреждения. Можно предотвратить повторное повреждение тканей при ЧМТ; появление аритмий, порой фатальных, после тромболизиса и ангиопластики коронарных сосудов; развитие полиорганной недостаточности, острой почечной недостаточности, ОРДС при тяжелой сочетанной травме; острый коронарный синдром при восстановлении кровообращения в конечностях при синдроме Лериша, диабетической стопе.
Аллопуринол в качестве профилактики реперфузионного синдрома должен применяться на этапе скорой помощи перед проведением тромболизиса или ангиопластики у больных с инфарктом миокарда, ишемическим инсультом головного мозга, перед операцией у больных с острым тромбозом, ишемией, наложением жгута, при обширных хирургических операциях с предстоящей большой кровопотерей. Он должен стать патогенетически обоснованным средством профилактики вторичного повреждения тканей при любой значимой ишемии тканей.
Список используемой литературы
- Врублевский О. Ю. , Ардашев В. Н. , Тюрин В. П. и соавт. Опыт тромболитической терапии при инфаркте миокарда. //Воен. — мед. журн. — 1997. — №11. — С. 40-45 .
- Госпитальная хирургия. Синдромология: учебное пособие Абдуллаев А. Г. и др. ; под ред. Н. О. Миланова — 2013. – 440 с. [Hospital surgery. Sindromology: education guidance Abdullaev A. G. , etc. ; under the editorship of N. O. Milanov — 2013. – 440 pages].
- Зильбер А. П. «Медицина критических состояний» Кн. 1. – 1995. С. 174-176 .
- Машковский М. Д. «Лекарственные средства» издание 16-е. -2014. — 1216 с. .
- Неврология и нейрохирургия под ред. А. Н. Коновалова. Учебник. 2009. — 420 с. .
- «Рекомендации по реваскуляризации миокарда». – Российский кардиологический журнал. – 2015. — №2. 81 с. [«Recommendations for myocardial revascularization». – Russian journal of cardiology. – 2015. — No. 2. 81 pages].
- Симоненков А. П. , Клюжев В. М. Синдром серотониновой недостаточности – М.: БИНОМ. 2013. – 96 с. .
- Appleby M. A. et al. Angiographic assessment of myocardial perfusion: TIMI myocardial perfusion (TMP) grading system. // Heart. 2001. Vol. 86, No 5. P. 485–486.
- Ganame J. et al. Impact of myocardial haemorrhage on left ventricular function and remodelling in patients with reperfused acute myocardial infarction. // Eur. Heart J. 2009. Vol. 30, No 12. P. 1440–1449.
- Garcia-Dorado D. et al. Calcium-mediated cell death during myocardial
reperfusion. // Cardiovasc. Res. 2012. Vol. 94, No 2. P. 168–180.
- Sivaraman V. , Yellon D. M. Pharmacologic Therapy That Simulates Conditioning for Cardiac Ischemic/Reperfusion Injury // J. Cardiovasc. Pharmacol. Ther. 2014. Vol. 19, No 1. P. 83–96.
- Ungi I. et al. Myocardial protection with enalaprilat in patients unresponsive to ischemic preconditioning during percutaneous coronary intervention. //Can. J. Physiol. Pharmacol. 2008. Vol. 86, No 12. P. 827–834.
- Widimsky P. et al. Reperfusion therapy for ST elevation acute myocardial infarction in Europe: description of the current situation in 30 countries. // Eur. Heart J. 2010. Vol. 31, No 8. P. 943–957.
- Jennings R. B. et al. Myocardial necrosis induced by temporary occlusion of a coronary artery in the dog. // Arch. Pathol. 1960. Vol. 70. P. 68–78.
- Zweier J. , Talukder M. The role of oxidants and free radicals in reperfusion injury // Cardiovasc. Res. 2006. Vol. 70, No 2. P. 181–190.
Зависит ли развитие реперфузионных аритмий от скорости проведения реперфузии?
Установлена связь между скоростью реперфузии, продолжительностью предшествующей ишемии и возникновением реперфузионных аритмий [3, 27, 37, 47]. Внезапное восстановление кровотока ведет к реоксигенации и вымыванию токсических метаболитов; это придает ткани гетерогенность и электрическую нестабильность, что, в свою очередь, приводит к развитию аритмий [3, 14, 24]. Продолжительность ишемии влияет на выраженность метаболического повреждения в реперфузионный период: чем длиннее период ишемии миокарда, тем больше степень ишемического/реперфузионного повреждения и выше частота развития РА [9, 25, 39].
Имеется ли зависимость между реперфузионными аритмиями и предшествующей ишемией?
Прослеживается связь между развитием РА и степенью обратимой ишемии; похоже, что в некротизированных клетках РА не возникают [25, 43, 44]. Это предположение объясняет тот факт, что для развития некоторых РА необходима энергия (в виде АТФ). Считают, что пик возникновения РА находится между 5-й и 20-й минутами после восстановления кровотока, а снижение частоты их появления прямо пропорционально истощению запасов АТФ [8, 43].
Каким образом интервенционные вмешательства влияют на развитие реперфузионных аритмий?
Наблюдающаяся при интервенционных вмешательствах эмболизация дистальных отделов не может не играть роли в развитии реперфузионных аритмий. Особое влияние на развитие клинически значимой эмболизации оказывает проведение стентирования, причем более выраженное, чем при ангиопластике [8]. По данным J. Henriques и соавт. [31], проанализировавших результаты первичной ангиопластики у 178 больных с ОИМ, частота выявления признаков значительной эмболизации (по данным ангиографии с образованием дистальных дефектов наполнения контраста) составляет 15,2 %, причем у 73 % больных при этом регистрировался хороший эпикардиальный кровоток (класс TIMI 3). Развитие эмболизации чаще регистрировали у больных с передней локализацией инфаркта, на фоне повторного инфаркта, многососудистого поражения. Через 72 ч после процедуры окончательный размер инфаркта миокарда, измерявшийся по данным серийного анализа лактатдегидрогеназы, у больных с эмболизацией в 2 раза превышал размер инфаркта у больных без эмболизации. Ожидаемыми были и результаты 5-летнего наблюдения: умирали за этот период 44 % больных при развитии эмболизации и 9 % без таковой (Р <� 0,001).
Авторы, которые изучали значение реперфузионных аритмий, встречающихся после успешной реканализации закрытой коронарной артерии вследствие проведения перкутанной чрескожной коронарной ангиоплстики у больных с острым коронарным синдромом с подъемом сегмента ST указывали, что возникновение РА сразу после ПТКА свидетельствует о благоприятном прогнозе у данной категории больных [32]. У 688 пациентов, из которых 22 % были женщинами, средний возраст составил 61 ± 14 лет, сахарный диабет встречался у 25 %, дислипидемия — у 55 %, артериальная гипертензия — у 43 %, курильщиками были 41 % пациентов. РА были зарегистрированы у 200 пациентов, или 29 %. У пациентов с РА реже выявлялся СД (16 против 30 %, P <� 0,01) и АГ (48 против 62 %, P <� 0,01), и у них было более короткое среднее время «боль — баллон» (201 против 234 минут, P <� 0,01), чем у пациентов без РА. Тридцатидневная смертность составила соответственно 3,7 и 8,3 % для пациентов с РА и без них (P = 0,04).Относительный риск смертности у пациентов с РА составил 0,46 (95% доверительный интервал 0,23–0,92) в течение 466 дней.
Результаты
Наше обращение к эпигастральному лоскуту обусловлено тем, что этот лоскут на поверхностных эпигастральных сосудах — единственный известный нам лоскут, в котором аксиальную артерию сопровождает только одна, а не две бесклапанные аксиальные вены. В качестве контроля мы использовали морфометрические данные сосудов кожи в области разметки этого лоскута. Численная плотность артериальных сосудов в коже в пределах разметки эпигастрального лоскута составила 4,48 [4,48; 5,19] на 1 мм2. Венозные аксиальные сосуды и их ветви имели слегка извитой ход. Преобладало дихотомическое деление сосудов (рис. 1 и 2). Показатели численной плотности венозных сосудов в коже области разметки эпигастрального лоскута составили 18,06 [16,56; 20,53] на 1 мм2. При этом микроциркуляторное русло равномерно прокрашивается. Диаметр аксиальных сосудов: а=39,5 [28,3; 43,1] мкм; v=67,7 [57,4; 70,1] мкм.
Рис. 1. Артериальное русло кожи в пределах разметки эпигастрального лоскута.
Инъекция синей массы Героты. Ув. ×16.
Рис. 2. Венозное русло кожи в пределах разметки эпигастрального лоскута.
Инъекция синей массы Героты. Ув. ×16.
Во второй (опытной) группе животных выделенные из структуры ангиосома эпигастральные лоскуты были не только лишены связи с окружающими тканями на уровне кожи, подкожной клетчатки и собственной фасции, но и хирургически денервированы на уровне сосудистой ножки: периартериальная + перивенозная симпатэктомия. Денервация сосудистой ножки прерывает чувствительную спинномозговую и сосудодвигательную иннервацию сосудистого русла несвободного лоскута. В данной экспериментальной группе у 10 (40%) из 25 животных наступил некроз лоскута, связанный с ранним венозным тромбозом аксиальных сосудов, т.е. на 3-и сутки после операции. Неосложненное послеоперационное течение было у 15 (60%) животных.
Особенность реакции сосудистого русла в полностью денервированном несвободном эпигастральном лоскуте состояла в том, что основные изменения происходили в артериальных сосудах. С первых суток они проявлялись дилатацией и извитостью артерий на фоне немного дилатированных, но прямолинейно расположенных вен (рис. 3а, 3б).
Рис. 3. Сосудистое русло кожи центральной части несвободного эпигастрального лоскута после полной хирургической денервации, 3-и сутки после операции.
Инъекция синей массы Героты. Ув. ×16. а — артериальное русло: видны расширенные и извитые кожные артерии; б — венозное русло: дилатированные, прямолинейно расположенные вены.
Динамика изменения диаметра сосудов кожи эпигастральных лоскутов после полной хирургической денервации характеризовалась двухфазной реакцией: уменьшением диаметра артерий и вен в течение первых 3 сут после операции, затем статистически значимым увеличением их диаметра на 7-е сутки (p<0,05). Явления вазодилатации сохранялись почти в неизменном состоянии до 14-х суток (табл. 1).
Таблица 1. Диаметр осевых артерий и вен (мкм) эпигастрального лоскута после периадвентициальной симпатэктомии сосудистой ножки, Me [Q25; Q75]
| Срок | Диаметр артерии | Диаметр вены |
| 3-и сутки | 30,23 [27,4; 33,3]#» | 35,1 [31,2; 36,0]* |
| 7-е сутки | 47,0 [44,1; 49,6]^ | 48,1 [34,4; 66,1] |
| 14-е сутки | 45,2 [40,2; 48,6]^ | 41,3 [34,0; 43,5]* |
| Контроль | 39,5 [28,3; 43,1] | 67,7 [57,4; 70,1]^» |
Примечание. ^ — p<0,05 при сравнении с 3-ми сутками; # — p<0,05 при сравнении с 7-ми сутками; » — p<0,05 при сравнении с 14-ми сутками; * — p<0,05 при сравнении с группой контроля.
Периферическое кровоснабжение в денервированном несвободном лоскуте и приживление в реципиентном ложе
При неосложненном течении послеоперационного периода сразу после денервации сосудистой ножки и транспозиции выделенного эпигастрального лоскута цвет кожи лоскута бледно-розовый; симптом исчезающего пятна — 2 с; умеренная отечность лоскута; контактное кровотечение (игла G25) — кровь красного цвета. Повязка умеренно промокала геморрагическим отделяемым, кожные швы спокойные, состоятельные. На 3-и сутки: цвет кожи лоскута розовый; симптом исчезающего пятна — 2 с; сохраняется умеренный отек лоскута; контактное кровотечение (игла G25) — кровь красного цвета. Полное приживление лоскута происходило к 10-м суткам: цвет кожи розовый, симптом исчезающего пятна — 3 с; сохраняется умеренный отек лоскута; контактное кровотечение (игла G25) — кровь красного цвета. Мелкое, ячеистое шелушение кожных покровов. К 14-м суткам кожные покровы лоскута в проекции рубца не выступали над поверхностью реципиентного ложа; множественные мелкие волоски. Рубец широкий, атрофический (рис. 4).
Рис. 4. Несвободный эпигастральный лоскут после его транспозиции с хирургической денервацией (неосложненное течение).
Широкий атрофический кожный рубец, 14-е сутки после операции.
В третьей (опытной) группе животных — реплантация полностью денервированного свободного эпигастрального лоскута по P.G. van der Sloot (2002); в отличие от полностью хирургически денервированного несвободного лоскута ситуация усугублялась пролонгированной первичной ишемией. Несмотря на 60—90-минутную первичную ишемию и синдром ишемии/реперфузии (компенсированный), в 91% случаев послеоперационное течение было неосложненным. Осложненное течение с гибелью лоскутов на 3-и сутки было в 9% случаев. Причина — тромбоз бедренной вены.
Микроанатомия сосудистого русла в полностью денервированном свободном эпигастральном лоскуте отличалась от микроанатомии сосудов в полностью денервированном несвободном эпигастральном лоскуте. Если после реперфузии полностью денервированного свободного лоскута (реплантата) сосудистые реакции касались в равной степени артериального и венозного звеньев, то после транспозиции полностью денервированного несвободного эпигастрального лоскута основные сосудистые реакции касались в основном артериального звена (рис. 5 и 6, табл. 2).
Рис. 5. Артериальное русло реплантированного эпигастрального лоскута, 3-и сутки после операции.
В центре — дилатированная аксиальная артерия. Инъекция синей массы Героты. Ув. ×16.
Рис. 6. Венозное русло реплантированного эпигастрального лоскута, 3-и сутки после операции.
В центре — резко расширенная аксиальная вена. Инъекция синей массы Героты. Ув. ×16.
Таблица 2. Диаметр осевых артерий и вен (мкм) свободного эпигастрального лоскута после его реперфузии, Me [Q25; Q75]
| Срок | Диаметр артерии | Диаметр вены |
| 3-и сутки | 26,1 [21,7; 29,3]#» | 39,0 [35,8; 40,1]#»* |
| 7-е сутки | 51,0 [48,1; 53,7]^* | 89,0 [84,6; 90,5]^»* |
| 14-е сутки | 47,0 [46,1; 48,0]^ | 71,2 [67,3; 72,8]^# |
| Контроль | 39,5 [28,3; 43,1]# | 67,7 [57,4; 70,1]^# |
Примечание. ^ — p<0,05 при сравнении с 3-ми сутками; # — p<0,05 при сравнении с 7-ми сутками; » — p<0,05 при сравнении с 14-ми сутками; * — p<0,05 при сравнении с группой контроля.
Примечательно, что в свободном реперфузируемом эпигастральном лоскуте (реплантате) значительная дилатация и извитость артериальных и венозных сосудов была весьма продолжительной, уменьшалась она только к 14-м суткам. Эти сосудистые реакции отличаются от тех, которые наступают после полной хирургической денервации лоскута. Они могут исчезнуть только после полной реиннервации паравазальных сосудодвигательных нервов, которая, по нашим данным, наступает через 30 сут после хирургического восстановления целостности пересеченных нервов [11]. Поэтому сосудистые реакции в реперфузируемом кожно-фасциальном (эпигастральном) лоскуте, выявляемые до 14-х суток после операции, можно интерпретировать как реперфузионное повреждение мышечной оболочки артериальных и венозных сосудов.
Периферическое кровообращение в денервированном свободном лоскуте и приживление в реципиентном ложе
В течение первых 2 ч после реперфузии лоскут был бледным. Умеренное пропитывание повязки кровью и серозным отделяемым по ходу раны; симптом исчезающего пятна — 2 с; контактное кровотечение (игла G25) — кровь красного цвета. На 3-и сутки после операции окраска реплантата соответствовала таковой окружающих тканей; симптом исчезающего пятна — 2 с; умеренная отечность лоскута; контактное кровотечение (игла G25) — кровь красного цвета (рис. 7).
Рис. 7. Свободный эпигастральный лоскут после его пересадки (неосложненное течение), 3-и сутки после операции.
Цвет кожи лоскута соответствует окраске кожных покровов окружающих тканей.
К 5-м суткам в области краев раны — участки шелушения эпидермиса; воспалительный процесс отсутствовал; капиллярный ответ (симптом исчезающего бледного пятна) был положительным. При надавливании зажимом лоскут бледнел, а через 2 с после прекращения давления восстанавливалась естественная окраска лоскута. Рана заживала первичным натяжением к 10—14-м суткам (рис.  .
.
Рис. 8. Свободный эпигастральный лоскут на 14-е сутки после его пересадки (неосложненное течение).
Нормотрофический кожный рубец.
Могут ли реперфузионные аритмии быть причиной внезапной коронарной смерти?
Имеются данные, что реперфузионные аритмии могут быть причиной внезапной смерти в остром периоде инфаркта миокарда. Пациенту с ОИМ была проведена успешная коронарная реканализации артерии с помощью ПТКА. В течение одной минуты после введения и раздувания баллона развился идиовентрикулярный ритм, сопровождающийся падением гемодинамики. Синусовый ритм был немедленно восстановлен, при повторно раздуваемом баллоне, и таким образом повторно прервалась оксигенация крови. Авторы предполагают, что реперфузия с последующей реоксигенацией крови является одним из первичных факторов аритмогенеза [13].
Синдром Дресслера
Постинфарктный синдром (или синдром Дресслера) — реактивное аутоиммунное осложнение инфаркта миокарда, развивающееся через 2—6 недель после его начала.
Частота развития
Первоначально считалось, что синдром Дресслера возникает примерно у 4% больных, перенесших инфаркт миокарда. C учетом атипичных и малосимптомных форм частота его развития значительно выше – 15–23 %, а по некоторым источникам достигает 30 %. Однако в последние годы частота синдрома Дресслера уменьшилась. Причинами могут быть широкое использование нестероидных противовоспалительных средств (ацетилсалициловой кислоты) и распространение реперфузионных методов лечения ИМ, уменьшающих объем повреждения мышцы сердца. Другой причиной снижения частоты развития синдрома Дресслера может быть включение в комплекс терапии инфаркт миокарда ингибиторов ангиотензинпревращающего фермента, антагонистов альдостерона и статинов, вследствие их иммуномодулирующего и противовоспалительного действия. Постинфарктый синдром развивается в подостром периоде (не ранее 10-го дня от момента заболевания) у 3—4 % пациентов, перенёсших инфаркт миокарда.
Причины развития
Основная причина синдрома Дресслера – инфаркт миокарда. Считается, что синдром Дресслера чаще развивается после крупноочаговых и осложненных инфарктов, а также после кровотечений в полость перикарда. Синдром Дресслера, точнее синдром постповреждения сердца, может развиваться после кардиохирургических вмешательств (постперикардиотомический синдром, посткомиссуротомический синдром). Помимо этого, типичные признаки синдрома Дресслера могут появляться после других повреждений сердца (ранение, контузия, непроникающий удар в область грудной клетки, катетерная абляция). В настоящее время синдром Дресслера рассматривается как аутоиммунный процесс, обусловленный аутосенсибилизацией к миокардиальным и перикардиальным антигенам. Определенное значение придается также антигенным свойствам крови, попавшей в полость перикарда.
При постинфарктном синдроме антитела к тканям сердца обнаруживаются постоянно. При анализе субпопуляций лимфоцитов у пациентов с синдром Дресслера было обнаружено увеличение числа активированных CD8-позитивных клеток. При изучении активации комплемента было отмечено, что у пациентов с СД наблюдали повышенный уровень фракции C3d в сочетании с более низкой концентрацией С3. Кардиальные реактивные антитела, связываясь с циркулирующими кардиальными антигенами с формированием растворимых иммунных комплексов, могут фиксироваться в различных местах, приводя к комплементопосредованному повреждению ткани.
При постинфарктном синдроме наблюдаются изменения и в клеточном иммунитете. Так, имеются данные, что при синдроме Дресслера значительно повышен уровень цитотоксических T-клеток. Этиологическим фактором синдрома Дресслера может быть инфекция, в частности вирусная, поскольку у больных, у которых этот синдром развился после кардиохирургических вмешательств, часто регистрируют повышение титра противовирусных антител.
Симптомы и течение
Развивается на 2–4-й неделе инфаркта миокарда, однако эти сроки могут уменьшаться – «ранний синдром Дресслера» и увеличиваться до нескольких месяцев, «поздний синдром Дресслера». Иногда течение синдрома Дресслера принимает агрессивный и затяжной характер, он может длиться месяцы и годы, протекать с ремиссиями и обострениями. Основные клинические проявления синдрома: лихорадка, перикардит, плеврит, пневмонит и поражение суставов. Лихорадка при синдроме Дресслера не имеет какой-либо строгой закономерности. Как правило, она бывает субфебрильной, хотя в отдельных случаях может быть фебрильной или вообще отсутствовать.
Перикардит является обязательным элементом синдрома Дресслера. Клинически он проявляется болью в перикардиальной зоне, которая может иррадиировать в шею, плечо, спину, брюшную полость. Боль может быть острой приступообразной (плевритическая) или давящей, сжимающей (ишемической). Она может усиливаться при дыхании, кашле, глотании и ослабевать в вертикальном положении или лежа на животе. Она длительная и исчезает или ослабевает после появления в полости перикарда воспалительного экссудата. Главный аускультативный признак перикардита – шум трения перикарда: в первый день болезни при внимательной аускультации он определяется у абсолютного большинства (до 85 %) больных. Шум лучше всего выслушивается у левого края грудины, при задержке дыхания и наклоне туловища пациента вперед. В классическом варианте он состоит из трех компонентов – предсердного (определяется в систолу) и желудочкового (систолического и диастолического). Как и боль, шум трения перикарда уменьшается или исчезает вовсе после появления в полости перикарда выпота, раздвигающего трущиеся листки перикарда. Обычно перикардит протекает нетяжело: уже через несколько дней боли стихают, а экссудат в полости перикарда почти никогда не накапливается в таком количестве, чтобы ухудшить кровообращение, хотя иногда могут появиться признаки тяжелой тампонады сердца. Иногда воспалительный процесс в перикарде при синдроме Дресслера принимает затяжной рецидивирующий характер и заканчивается развитием констриктивного перикардита. При применении антикоагулянтов на фоне синдрома Дресслера возможно также развитие геморрагического перикардита, хотя подобное осложнение может быть и при отсутствии антикоагулянтной терапии.
Плеврит. Проявляется болью в боковых отделах грудной клетки, усиливающейся при дыхании, затруднением дыхания, шумом трения плевры, притуплением перкуторного звука. Он может быть сухим и экссудативным, односторонним и двусторонним. Нередко плеврит носит междолевой характер и не сопровождается типичными физикальными симптомами.
Пневмонит. Пневмонит при синдроме Дресслера выявляется реже, чем перикардит и плеврит. Если очаг воспаления достаточно велик, также отмечается притупление перкуторного звука, ослабленное или жесткое дыхание, появление фокуса мелкопузырчатых хрипов. Возможен кашель и выделение мокроты, иногда с примесью крови, что всегда вызывает определенные диагностические трудности.
Поражение суставов. Для синдрома Дресслера характерно появление так называемого «синдрома плеча»: болезненных ощущений в области плечелопаточных суставов, чаще слева, ограничение подвижности этих суставов. Вовлечение в процесс синовиальных оболочек нередко приводит к возникновению болей и в крупных суставах конечностей.
Другие проявления. Проявлением постинфарктного синдрома может быть сердечная недостаточность вследствие диастолической дисфункции, геморрагический васкулит и острый гломерулонефрит.
Методы исследования
Лабораторные данные. Часто отмечается повышение СОЭ и лейкоцитоз, а также эозинофилия. Весьма характерно резкое повышение уровня С-реактивного белка. У больных с синдромом Дресслера регистрируются нормальные уровни маркеров повреждения миокарда (МВ-фракция креатинфосфокиназы (МВ-КФК), миоглобин, тропонины), хотя иногда отмечается их незначительное повышение, что требует проведения дифференциальной диагностики с рецидивом инфаркта миокарда.
Электрокардиография (ЭКГ). При наличии перикардита на ЭКГ определяются диффузный подъем сегмента ST и, периодически, депрессия сегмента PR, за исключением отведения aVR, в котором наблюдаются депрессия ST и подъем PR. По мере накопления экссудата в полости перикарда может снизиться амплитуда комплекса QRS.
Эхокардиография. При накоплении жидкости в полости перикарда выявляется сепарация его листков и могут появиться признаки тампонады сердца. Для синдрома Дресслера не характерен большой объем жидкости в полости перикарда – как правило, сепарация листков перикарда не достигает 10 мм в диастолу.
Рентгенография. Обнаруживают скопление жидкости в плевральной полости, междолевой плеврит, расширение границ сердечной тени, очаговые тени в легких.
Компьютерная или магнитнорезонансная томография также выявляют жидкость в полости плевры или перикарда и легочную инфильтрацию.
Плевральная и перикардиальная пункция. Извлеченный из полости плевры или перикарда экссудат может быть серозным или серозно-геморрагическим. При лабораторном исследовании в нем определяется эозинофилия, лейкоцитоз и высокий уровень С-реактивного белка.
Лечение
Нестероидные противовоспалительные препараты (НПВС). Препаратом выбора при синдроме Дресслера традиционно считается ибупрофен (400– 800 мг/сут). Реже используют аспирин. Хирургическое лечение применяется при констриктивном перикардите.
Осложнения
Тампонада сердца, геморрагический или констриктивный перикардит, окклюзия (сдавление) коронарного шунта и редко – анемия.
Прогноз
Прогноз при синдроме Дресслера, как правило, благоприятный. Вместе с тем его течение иногда принимает затяжной рецидивирующий характер. Кроме того, имеются данные о том, что выживаемость в течение 5 лет среди перенесших этот синдром, хотя и незначительно, но снижается.
Возможно ли предотвратить развитие реперфузионных аритмий с помощью лекарственной терапии?
Данные экспериментальных и клинических исследований последних лет указывают на возможность профилактики реперфузионного повреждения КМЦ с помощью использования лекарственных препаратов, обладающих мембранопротекторными свойствами (триметазидин, магния сульфат, кверцитин), что ведет к ограничению зоны некроза, предупреждению дилатации полости левого желудочка, повышению электрической стабильности миокарда и, следовательно, уменьшению частоты возникновения РА [1, 2, 9, 38].
Некоторые авторы указывают на кардиопротекторное действие ингибиторов ангиотензинпревращающего фермента (АПФ) [34, 40, 45]. Ангиотензин II является одним из медиаторов возникновения реперфузионного повреждения и РА; он способствует укорочению рефрактерного периода и повышению частоты сердечных сокращений [30, 50]. Вазоконстрикторный эффект ангиотензина II создает кислородный дефицит, что может приводить к ишемии миокарда, которая является мощным аритмогенным фактором. Установлено, что ангиотензин II усиливает поток Са2+ не только через L-тип Са2+-каналов, но и способствует его выходу из внутриклеточных запасов посредством рецепторов 1-го типа к ангиотензину II; кроме того, он способствует высвобождению катехоламинов, что также приводит к перегрузке Са2 [18, 20]. Положительные эффекты ингибиторов АПФ реализуются посредством блокирования продукции ангиотензина II и увеличения количества брадикинина, что может стимулировать выработку простагландинов и оксида азота [34, 40]. К тому же ингибиторы АПФ предупреждают развитие вазоспазма и повышение агрегации тромбоцитов, а также являются донатором сульфгидрильных групп, связывающих свободные радикалы [50]. В последнее время изучается роль оксида азота (NO) при ишемическом/реперфузионном повреждении, однако точные механизмы его протекторного действия на миокард до сих пор не установлены. Предполагается, что основные его кардиозащитные эффекты реализуются путем устранения Са2+-перегрузки КМЦ, снижения сократимости сердечной мышцы и потребления ею кислорода, антагонизма бета-адренергической стимуляции, антиоксидантного действия, открытия К+-АТФ-каналов, устранения феномена no-reflow и лейкоцитарной инфильтрации, снижения высвобождения цитокинов [16, 44, 52].
Хотя Са2+ является основным патологическим звеном возникновения реперфузионного повреждения и РА, использование блокаторов Са2+-каналов не нашло широкого применения [3, 43, 51]. В то же время доказана эффективность таких препаратов, как магния сульфат, аденозин, дипиридамол, основной механизм действия которых реализуется путем модулирования трансмембранного потока ионов Са2+ и устранения кальциевой перегрузки КМЦ [23, 38, 46].
Таким образом, развитие РА вследствие реперфузионного повреждения миокарда является феноменом, имеющим глубокую биохимическую и нейрогуморальную основу. Изучение тонких электрофизиологических, метаболических механизмов возникновения РА необходимо как для оптимизации сроков и способа восстановления коронарного кровотока, предупреждения развития жизненно опасных аритмий, так и воздействия на ключевые патогенетические звенья реперфузионного повреждения.
Вышеизложенные данные свидетельствуют о назревшей необходимости разработки новых подходов к системному и внутрикоронарному тромболизису, а также хирургической реваскуляризации, позволяющих существенно уменьшить опасность реперфузионных повреждений.
Этиопатогенез реперфузионных повреждений в хирургии сосудов нижних конечностей
Оборин Александр Андреевич
Государственное бюджетное учреждение здравоохранения Пермского края «Ордена «Знак Почёта» Пермская краевая клиническая больница», отделение сердечно-сосудистой хирургии, Пермь, Россия Контакты:
Реферат. Представленный обзор освещает тему повреждающей реоксигенации тканей при реваскуляризации нижней конечности. Рассматриваются возможные механизмы возникновения: от клеточных и молекулярных основ до клинических проявлений, а также поведение гемодинамики на уровне микро- и макроциркуляции. Реперфузионный синдром является обязательным явлением при восстановлении кровотока после продолжительной ишемии, однако стоит вопрос о выраженности данного состояния. Кроме того, встает вопрос о профилактике и коррекции. Множество врачей в общехирургических и специализированных отделениях вынуждены сталкиваться с острой ишемией конечности и, как следствие, развитием повреждающей реоксигенации при успешно выполненной реканализации. Происходит развитие необратимой клеточной гибели ткани. К сожалению, сохранить конечность в такой ситуации удается далеко не всегда. Стоит задача поиска оптимального ангиопротектора, так как основные постокклюзионные изменения происходят именно со стенкой сосуда. Эти и другие вопросы подробно рассматриваются в представленных материалах.
КЛЮЧЕВЫЕ СЛОВА: хирургия сосудов нижних конечностей, реперфузионное повреждение, реваскуляризация, реоксигенация.
Введение
Еще в 1885 г. при попытке проведения одной из первых эмболэктомий из бедренной артерии русским хирургом Ф. Сабанеевым предполагалось в дополнение к эмболэктомии (для предупреждения поступления в организм токсичных продуктов из ишемизированных тканей) проводить промывание сосудистого русла ишемизированной конечности физиологическим раствором через бедренную вену [1]. Реперфузионный синдром, или феномен «no-reflow» (феномен невосстановленного кровотока), заключается в усугублении тяжести ишемии после проведения технически успешной реканализации артериального сегмента и характеризуется отсутствием адекватного кровотока на тканевом уровне. Стоит отметить, что реперфузионный синдром является не столько непредвиденным осложнением, сколько программируемым и неотъемлемым состоянием после радикально выполненных хирургических вмешательств у данной категории больных. В изученной литературе освещается реперфузионный синдром после реваскуляризации миокарда и головного мозга как при хронической, так и при острой ишемии [2]. Однако данная проблема встречается после реконструктивных операций на артериях нижних конечностей, что диктует более подробное изучение феномена «no-reflow», поиск диагностики и адекватного лечения при возникновении повреждающей реперфузии. Технически удачно выполненное вмешательство не гарантирует восстановления периферического кровотока и сохранения конечности, если неадекватно сформирован до- и послеоперационный период, где одним из основных осложнений является реперфузионный синдром. В практической медицине возникла настоятельная необходимость в изучении показателей повреждения клеток и тканей в целях диагностики, оценке функционального состояния повреждения органов [3].
Содержание обзора
F.W. Blaisdell в своей работе, посвященной патофизиологии реперфузии, назвал повреждающую оксигенацию как совокупность осложнений, следующих за восстановлением артериального кровотока в ранее ишемизированных органах и тканях. Общепринято, что развитие реперфузионного синдрома во многом определяется исходным состоянием регионарной микроциркуляции. Л.П. Чурилов раскрывает повреждающие механизмы постокклюзионной гиперемии, говоря, что ранее голодавшие клетки жадно поглощают кислород, образуя такое количество перекисных соединений, с которыми не могут справиться антиоксидантные системы, резко усиливается перекисное окисление липидов, что приводит к прямому повреждению клеточных мембран и свободно-радикальному некробиозу [4]. Системное влияние активных метаболитов перекисного окисления липидов определяется способностью последних выходить из мембран в связи с их более выраженной гидрофильностью в сравнении с исходными липидами, и это делает продукты ПОЛ одним из важных факторов в патогенезе генерализованных гемодинамических расстройств в организме. Окисленные фосфолипиды обладают выраженным вазоактивным и кардиотропным действием. В реперфузионном периоде продукты ПОЛ оказывают вазоконстриктивный эффект на органные, тканевые сосуды, подвергшиеся ишемическому воздействию, вызывая системный гипотензивный эффект за счет отрицательного инотропного и кардиодепрессивного влияния [5]. Повреждающие эффекты ишемии не становятся очевидными до тех пор, пока в орган не поступит насыщенная кислородом кровь [6]. Этот факт позволяет некоторым авторам называть ишемию и последующую реперфузию «двойным ударом» (a «two-hit» injury) [7]. Развитие сердечно-сосудистой, легочной, почечной недостаточности различной степени тяжести является клиническим проявлением реперфузионного повреждения органов и тканей после оперативного вмешательства на брюшной аорте [8]. Основной губительный фактор для клетки при прекращении кровотока – гипоксический некробиоз. Некробиоз – процесс отмирания клетки, глубокая, частично необратимая стадия повреждения клетки, непосредственно предшествующая ее смерти. Суть заключается в утрате способности клетки производить АТФ, потере калия, снижении pH цитоплазмы, снижении активности ферментативных систем, насыщении клетки кальцием и натрием. Снижение pH приводит к угнетению фосфофруктокиназы (снижение анаэробного распада), а также к денатурации некоторых белков [9]. А избыточная концентрация кальция является токсической для клетки. Истощение запасов АТФ и одновременное увеличение концентрации молочной кислоты вызывает деполяризацию мембран с нарушением транспорта через нее веществ за счет развивающейся дисфункции ионных насосов. Калий выходит из клетки, вызывая увеличение объема внеклеточной жидкости и развитие ишемического отека органа, а натрий и кальций поступают в нее, в результате чего происходит увеличение внутриклеточного объема с повреждением внутриклеточных структур, в первую очередь, энергетически значимых митохондрий [10].
Как уже говорилось ранее, в обескровленных тканях образуется большое количество пуриновых оснований (т.к. клетка в условиях нехватки кислорода переходит на анаэробное питание), которые, в свою очередь, в условиях резкого улучшения кровоснабжения являются главными поставщиками свободно-радикальных молекул. При этом активность супероксиддисмутазы, каталазы и глутатионредуктазы, ответственных за нейтрализацию свободных радикалов, угнетена вследствие воздействия ишемии [11]. Активные формы кислорода, взаимодействуя с белками и углеводами, вызывают нарушение процессов метилирования, окислительного дезаминирования и приводят к образованию ряда токсичных для организма веществ: перекисей, гидроперекисей, кетонов, альдегидов и др. Взаимодействуя с мембранами клеток, свободнорадикальные формы кислорода индуцируют перекисное окисление липидов мембран, изменение в структуре их белков с нарушением проницаемости, еще более подавляя биоэнергетические процессы в клетке. Дополнительным источником свободных радикалов может служить гиперпродукция оксида азота (NO является активным кислородсодержащим радикалом) вследствие стимуляции NOS (фермента, непосредственно участвующего в образовании оксида азота) в условиях гипоксии. Высвобождение большого количества свободных радикалов приводит к повреждению эндотелия и блоку микроциркуляции, что связано с отеком эндотелия и увеличением доли артериоло-венулярного шунтирования. Уменьшение интенсивности микроциркуляции и увеличение артериовенозного сброса являются основой важного компенсаторного механизма, запускаемого в ответ на реперфузионную травму. Данные изменения периферической макрогемодинамики возникают в связи с недостаточным восстановлением функции микроциркуляторной системы, которая не в состоянии справиться с резким увеличением притока артериальной крови. Это позволяет уменьшить дальнейшее повреждение тканей ишемизированного органа, а также проявления аутоинтоксикации [12].
По мнению авторов, в развитии синдрома реперфузии основной вклад вносят лейкоциты, скапливающиеся в зоне ишемии: полиморфноядерные лейкоциты способны высвобождать свободные радикалы с последующим повреждением эндотелия, протеолитические ферменты, включая матричные металлопротеиназы, лейкотриены, которые стимулируют тромбоциты и эндотелий. Происходит прогрессирование эндотелиальной дисфункции. В микроциркуляторном русле действие супероксида способствует деградации гиалуроновой кислоты эндотелиального коллагенового слоя и базальной мембраны, что ведет к микротромбозам и увеличению проницаемости сосудистой стенки и является причиной развития интерстициального отека. В свою очередь, переход жидкости в интерстициальное пространство ведет к сгущению крови, замедлению кровотока и образованию тромбов. Крыжановская С.А. с соавторами ранее подробно изучила данную проблему на примере развития «no-reflow» после вмешательства на коронарных артериях. Авторы описывают механизмы, участвующие в развитии феномена ишемии/реперфузии, приводя следующие: нарушения в системе ауторегуляции, механическая компрессия вследствие набухания клеток с развитием внутриклеточного и интерстициального отека; в свою очередь, отек ткани может привести к сдавливанию МЦР, нарушению свертывающей системы крови, микроэмболизации МЦР; дополнительные патогенетические факторы (артериальная гипертензия, сахарный диабет и т.д.). Хотя данные факторы описаны для сердечной мышцы, целесообразно соотнести их с мышечной тканью конечностей. Очевидно, что феномен «no-reflow» имеет мультифокальную природу и имеет множество механизмов, однако главную роль отводят микроэмболизации и повреждению МЦР в ходе реконструктивных вмешательств.
Во время процедуры реваскуляризации частички атероматозных и тромботических масс устремляются в более дистальные сосуды, порой полностью перекрывая доступ крови в капилляр. В случае повреждающей реперфузии большое значение имеет нестабильность бляшки. Как правило, естественная микроэмболизация невелика, но активное разрушение атеросклеротической бляшки (в большинстве случаев при ОКС – рыхлой, нестабильной, с нарушениями целостности покрышки) и фрагментация пристеночного тромба на ее поверхности имеют большое клиническое значение. Можно предположить, что в данном случае гораздо большую опасность представляют эндоваскулярные вмешательства. Например, при баллонной ангиопластике происходит механическое раздавливание атеросклеротической бляшки. Баллонная дилатация оттесняет фрагменты атеросклеротической бляшки в мышечный слой сосудистой стенки, что приводит к расширению внутреннего диаметра сосуда. Однако некоторая часть атероматозных масс может не перемещаться в глубокие слои стенки, а фрагментироваться в просвете сосуда. Эти фрагменты бляшки, как и тромботические наслоения, служат источником микроэмболизации дистальных сосудов, тогда как открытые хирургические вмешательства производятся на пережатии артерий, следовательно, исключается риск попадания атероматозных частичек в дистальное русло во время операции. При лечении больных ОААНК с острой непроходимостью магистральных артерий конечностей необходимо учитывать тот крайне важный факт, что восстановление проходимости сосуда (реперфузия) практически никогда сразу не сопровождается восстановлением кровотока до исходного уровня [13], а исход успешной реконструктивно-восстановительной операции на магистральных сосудах во многом обусловлен толерантностью тканей к реперфузионному повреждению. Ситуация осложняется при наличии сахарного диабета, в частности, синдрома диабетической стопы [14]. В клинической практике мы часто встречаемся с реперфузионным отеком [15] вследствие того, что микроциркуляторное русло в условиях повышения концентрации лактата увеличивает свою проницаемость, происходит нарушение баланса фильтрация/абсорбция со сдвигом в сторону первого; в этих условиях объем фильтрата превышает буферную емкость лимфатической системы, следовательно, происходит отек конечности. Отек – это прямое следствие нарушения эндотелиального барьера, которое представляет собой легко распознаваемый ответ капилляров на развитие воспалительного процесса во время ишемии/реперфузии. Состояние гиперпроницаемости обычно не является результатом выраженного повреждения эндотелиальных клеток или отслоения эндотелиальных клеток от стенки сосуда. Напротив, данная форма ответа отражает более тонкие изменения ультраструктуры эндотелиального монослоя, такие как расширение эндотелиальных параклеточных контактов, которые возникают в результате разобщения белков контактов и/или сокращения цитоскелета. Развитие гиперпроницаемости эндотелия, которая сопровождает воспалительный процесс, приписывают разнообразным медиаторам, которые связываются со специфическими эндотелиальными рецепторами [16] и открывают путь жидкости во внеклеточное пространство. Отек может быть тотальным, захватывающим как мышцы, так и подкожную клетчатку, или субфасциальным – поражающим лишь мышцы [17]. В свою очередь отечные ткани легче инфицируются и хуже заживают, что указывает на неблагоприятный прогноз течения заболевания.
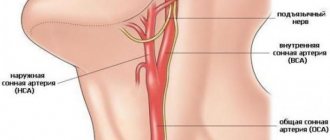
Наиболее фатально реперфузионный синдром протекает у пациентов с острой ишемией конечности, где ткань не успела адаптироваться к снижению кровотока; в период острой ишемии также недостаточно раскрыты коллатерали, что снижает компенсаторный резерв артериальных сегментов нижней конечности. Частота реперфузионных осложнений велика при реконструкции аорто-подвздошного сегмента, так как практически всегда объем данных вмешательств велик, а операция производится на пережатии аорты. Установлено также развитие «синдрома реперфузии» в структурах ранее ишемизированного мозга в постокклюзионный период в виде отека мозга, геморрагий [18]. Внезапная окклюзия внутренней сонной артерии нарушает ауторегуляцию и уменьшает кровоток в гомолатеральном полушарии. При окклюзии магистральной артерии в течение 10-15 минут возникают физико-химические изменения в крови: микроэмболии, постишемический отек эндотелия мелких сосудов, расстройства их регуляции, что при восстановлении проходимости артерии обуславливает феномен «невозобновления перфузии» в 50% объема мозгового вещества [19]. Наличие реперфузионного синдрома напрямую зависит от времени, в которое клетки ткани находились в условиях гипоксии. Быстро развивающаяся ишемия более патогенна для клеток, чем медленно прогрессирующая, поскольку последняя оставляет определенное время для адаптации и компенсации [20].
В механизме гипоксического некробиоза, особенно на глубоких стадиях, ключевую роль играет увеличение содержания ионизированного внутриклеточного кальция, избыток которого токсичен для клетки. Увеличение внутриклеточной концентрации кальция вначале обусловлено нехваткой энергии для работы кальций-магниевого насоса. При углублении гипоксии кальций попадает в клетку уже через входные кальциевые каналы наружной мембраны, а также массивным потоком из митохондрий, цистерн гладкого эндоплазматического ретикулума и через поврежденные клеточные мембраны. Это приводит к критическому нарастанию его концентрации. Длительный избыток кальция в цитоплазме ведет к активации кальций-зависимых протеиназ, прогрессирующему цитоплазматическому протеолизу. При необратимом повреждении клетки в митохиндрии поступают значительные количества кальция, что приводит к инактивации их ферментов, денатурации белка, стойкой утрате способности к продукции АТФ даже при восстановлении притока кислорода или реперфузии. Подводя итог, можно сказать, что в основе реперфузионных осложнений лежит избыточное поступление в условиях реканализации сосудов электролитов – кальция, натрия, а также воды, глюкозы, кислорода и других субстратов к альтерированным или некротизированным тканям, потерявшим способность их метаболизировать в типовых окислительно-восстановительных реакциях, а также в реакциях гликолиза, липолиза, протеолиза. Как можно заметить, основные события, связанные с реперфузией, происходят на уровне микроциркуляции, проявляются отеком эндотелия, лейкоцитарно-эндотелиальной адгезией, экстравазацией альбумина и нарушением релаксации артериол [21], а основными чувствительными органами к реперфузионным повреждениям являются почки, головной мозг, сердце и легкие. Наиболее часто (48%) происходит опосредованное через реперфузионные повреждения нарушение ритма сердца, а именно экстрасистолия. Еще одним проявлением реперфузионного синдрома является поражение почек. Приходящая почечная недостаточность (креатинин выше 0,13 ммоль/л) наблюдается у 30-50% больных, оперированных в плановом порядке, в 1-2% случаев развивается острая почечная недостаточность, что требует проведение диализной терапии [22].
Стоит отметить, что на данный момент нет рекомендаций по ведению пациентов с реперфузионным осложнением, не указано, какие методы или препараты наиболее рационально использовать для этих целей и в какой дозировке. Нет четкой, патогенетически обоснованной, инструментально и лабораторно доказанной эффективности применения различных групп препаратов в профилактике периоперационных осложнений [23]. Основные лабораторные и диагностические методы в изучении процессов реперфузии основаны на оценке состояния макрогемодинамики и микрогемодинамики [24,25], а также на изучении биохимических показателей регионарного кровотока. Так, Пшеников А.С. с соавторами исследовали уровень оксида азота (NO), фактора роста эндотелия сосудов (VEGF), проапоптотических белков (Bcl-2), белков теплового шока (HSP70) у пациентов с операбельной критической ишемией, как показатели функционального и морфологического состояния сосудистой системы. По данным исследования авторов при усугублении тяжести ишемии наблюдается значительное снижение данных маркеров. Для прогнозирования реперфузионных осложнений со стороны дыхательной системы имеет смысл использовать данные коагулограммы: при сдвиге в сторону гиперкоагуляции стоит ожидать симптоматику дыхательной недостаточности при восстановлении кровотока. Наиболее информативным показателем состояния микроциркуляции на момент реконструктивных вмешательств является транскутанное напряжение кислорода. В качестве защиты клеток от реперфузионных повреждений на момент вмешательств на аорто-подзвдошном сегменте предлагалось использовать газотранспортные препараты. Так, Ворошилин В.В. предложил использовать перфторан, т.к. внутривенно вводимый ПФ улучшает газообмен и метаболизм на уровне тканей, увеличивает кислород-транспортную функцию крови, восстанавливает центральную и периферическую гемодинамику, улучшает реологические свойства крови и микроциркуляцию, вызывает дезагрегацию тромбоцитов и эритроцитов, снижая концентрацию фибриногена и фактора XIII. Помимо этого, он устраняет последствия внутрисосудистого свертывания крови и реканализации сосудистого русла; являясь мембраностабилизатором, мягким осмодиуретиком, блокатором медленных кальциевых каналов, растворяясь в мембранах, повышает резистентность клетки к ишемическому и реперфузионному поражению. Одним из эффектов перфторуглеродов, обусловливающих улучшение микроциркуляции, является образование оксида азота, позволяющего купировать вазоспазм микроциркуляторного русла [26,27]. Однако высокая стоимость препарата (от 10400,00 до 11050,00 руб. за 200 мл по г. Москва) не позволяет использовать его повсеместно во всех отделениях ангиохирургии страны, при том что использовать предполагается его в дозировке 5 мл/кг.
Выводы
Таким образом, проблема реперфузионного повреждения органов не является решенной. Наиболее значимой является профилактика повреждающей реоксигенации тканей в период острой ишемии, где быстро нарастающая ишемия может стать угрозой для конечности, а проведение тромбоэмболоктомии может спровоцировать осложнение со стороны дыхательной системы, почек, сердца, а также продолжающееся прогрессирование ишемии конечности.
Наиболее частым и относительно безобидным проявлением послеоперационной реперфузии является отек как местное расстройство. Наиболее неблагоприятным – развитие полиорганной недостаточности с усилением тяжести ишемии конечности. Исходя из всего вышесказанного, вариантом решения данной проблемы является протекция чувствительных органов к повреждающей реоксигенации, в том числе и микроциркуляторного русла, а также увеличение газотранспортной функции и улучшение реологических свойств крови. Необходимо предусматривать развитие данного рода осложнений при проведении операций по поводу ишемии конечности как острого, так и хронического характера.
Литература
- Гавриленко А.В., Шабалтас Е.Д. Cостояние микроциркуляции при реперфузионном синдроме после реконструктивных операций на сосудах нижних конечностей. Хирургия, 2003, №2, С.62-65.
- Holmberg A, Sandhagen В, Bergqvist D. Hemorheologic variables in critical limb ischemia before and after infrainguinal reconstraction. J Vase Surg 2000, V.31, P.691-695.
- Молекулярные механизмы повреждения. Методические разработки для самостоятельной работы студентов медицинских ВУЗов. Под ред. Проф. Г.В. Порядина. М.: РГМУ, 2009.
- Чурилов Л.П. Общая патофизиология с основами иммунопатологии. Учебник для студентов медВУЗов. Издание 5-е. СПб.: ЭЛБИ-СПб, 2015, 256 с.
- Harkin DW, Barros D’Sa AA, McCallion K, et al. Bactericidal/permeability-increasing protein attenuates systemic inflammation and acute lung injury in porcine lower limb ischemia-reperfusion injury. Ann Surg 2001, Vol. 234, №2, P.233-244.
- Неймарк М.И., Меркулов И.В., Флат М.К. Протекция функции почек при оперативном лечении хронических инфраренальных аневризм аорты. Анестезиология и реаниматология, 2005, №4, С.18-22.
- Hernandez LA, Grisham MB, Twohig B, et al. Role of neutrophils in ischemia/reperfusion-induced microvascular injury. Am J Physiol, 1987, 253: H699-H703.
- Lundgren O, Haglund U. Intestinal ischemia and shock factors. Fed Proc, 1978; 37: 2729-33.
- Биленко М.В. Ишемические и реперфузионные повреждения органов (молекулярные механизмы, пути предупреждения и лечения). М.: Медицина, 1989. 368 с.
- Крыжановская С.А., Матюшин Г.В., Протопопов А.В. Феномен «no-reflow»: частота, причины возникновения, клинические проявления.
- Манухина Е.Б., Терехина О.Л., Белкина Л.М. и др. Вазопротекторный эффект адаптации при ишемическом и реперфузионном повреждении сердца. Патологическая физиология и эксперим. терапия, 2013, №4, С.26-31.
- Карпов Р.С., Дудко В.А. Атеросклероз: патогенез, клиника, функциональная диагностика, лечение. Томск: STT, 1998, 672 с.
- Калинин Р.Е. и др. Реперфузионное повреждение тканей в хирургии артерий нижних конечностей. Новости хирургии, 2015, №3, С.348-352.
- Абалмасов К.Г., Бузиашвили Ю.И., Морозов К.М. Качество жизни больных с хронической ишемией нижних конечностей. Ангиология и сосудистая хирургия, 2004, Том 10, №2, С.8-13.
- Сучков И.А. и др. Профилактика рестенозов в реконструктивной хирургии магистральных артерий. Наука молодых/Eruditio Juvenium, 2013, №2, С.12-19.
- Национальные рекомендации по ведению пациентов с заболеваниями артерий нижних конечностей. М., 2013, 74 с.
- Сологуб Т.В. и др. Свободнорадикальные процессы и воспаление (патогенетические, клинические и терапевтические аспекты). Учебное пособие для врачей. М.: Академия естествознания, 2008.
- Suzuki H, Schmid-Schonbein GW, Suematsu M. Impared leucocyte-endotelial cell interaction in spontaneosly hypertensive rats. Hypertension, 1994, V.24, P.719-727.
- Меркулов И.В., Неймарк М.И. Анестезия и интенсивная терапия в хирургии аорты и ее ветвей: монография. Петрозаводск: ИнтелТек, 2005, 272 с.
- Кузнецов М.Р., Кошкин В.М., Комов К.В. Современные аспекты диагностики, профилактики и лечения реперфузионного синдрома. Ангиология и сосудистая хирургия, 2006, Т.12, №1, С.133-143.
- Савельев В.С., Кошкин В.М. Критическая ишемия нижних конечностей. М.: Медицина, 1997, 160 с.
- Dick F, Li J, Giraud M-N, et al. Basic Control of Reperfusion Effectively Protects Against Reperfusion Injury in a Realistic Rodent Model of Acute Limb Ischemia. Circulation, 2008, Vol.118, №19, P.1920-1928.
- Щербак Н.С., Галагудза М.М., Юкина Г.Ю. и др. Морфофункциональные изменения пирамидных нейронов различных полей гиппокампа при ишемическом посткондиционировании. Морфология, 2013, №3, С.7-13.
- Барсуков А.Е., Махнов H.A. Дисфункция эндотелия: принципы диагностики и клиническая значимость при облитерирующем атеросклерозе периферических артерий. Вестник хирургии, 2005, Т.164, №1, С.102-104.
- Полянцев A.A., Мозговой П.В., Фролов Д.В. и др. Прогнозирование осложнений после реконструктивных операций на аортоподвздошном сегменте. Хирургия, 2004, №4, С.9-12.
- Зимон И.Н., Мавлянова Н.А. Дыхательные расстройства у больных с острой артериальной непроходимостью и ишемическим синдромом нижних конечностей. Хирургия, 1997, №7, С.16-18.
- Сергиенко В.И., Петросян Э.А., Оноприев В.И. и др. Морфологические изменения легких при моделировании и лечении ишемических и реперфузионных повреждений конечности. Общая реаниматология, 2006, Т.II, №5-6, С.129-132.
Комментарии к статье
Рейтинг статьи:
0/5
(нет оценок)
Комментарии отсутствуют