Открытый артериальный проток: причины, лечение, прогноз
Диагноз открытый артериальный проток (ОАП) нередко ставят недоношенным детям. Что означает этот диагноз? Почему возникает открытый артериальный проток? Всегда ли нужна операция? Об этом в прямом эфире «Право на чудо» мы поговорили с Григорием Валерьевичем Ревуненковым
, к.м.н., руководителем отдела инновационных диагностических методов исследования, врачом ультразвуковой диагностики НИИ педиатрии и охраны здоровья детей ЦКБ РАН.
Что такое открытый артериальный проток?
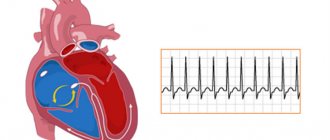
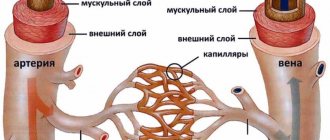
Это порок, который на одном из этапов внутриутробного развития ребенка не является пороком. Это один из видов фетальной коммуникации: без открытого артериального протока (Боталлового протока) внутриутробно ребенок не развивается. Поскольку легкие не участвуют в дыхании, они безвоздушные, кровь с высоким давлением должна куда-то выбрасываться. Именно по этому каналу она сбрасывается из легочного ствола (который наполняет кровью легкие) в аорту – сосуд, который отходит от левого желудочка и является самым крупным сосудом нашего организма.
Однако после рождения ребенка эта фетальная внутриутробная коммуникация должна закрыться. Почему? Легкие начинают работать, и как только меняется концентрация газов в крови после первого вдоха, проток сокращается (это некая трубочка, имеющая определенную длину, со стенками с мышечными волокнами). Проток сокращается и кровоток по нему достаточно быстро прекращается.
Однако первое время, когда только проток закрылся, возможна и обратная ситуация. Мышцы по какой-то причине могут расслабиться и проток может возобновить свою деятельность. Почему так происходит? По многим причинам. В том числе, при применении определенных медикаментов. Это могут быть глубоко недоношенные дети. Перечислять все факторы смысла особого не имеет.
Что потом происходит с открытым артериальным протоком?
Есть медикаменты, которые позволяют протоку закрыться. Это нестероидные противовоспалительные препараты, которые мы и в обычной жизни применяем – индометацин, ибуклин и так далее. Эти препараты позволяют закрыть проток у маленького ребенка. Но только в том случае, если мышечный аппарат, который отвечает за спазмирование этого сосуда, работает правильно.
В тех случаях, когда проток действительно крупный, или есть причина немедикаментозная, по которой проток остался открытым, иногда приходится решать вопрос об операции прямо в кувезе. Но для этого должны быть определенные условия.
Как диагностируется открытый артериальный проток?
При помощи очень популярного сейчас инструмента – эхокардиографии. Это ультразвуковое исследование сердца. Заграницей не принято всем делать эхокардиографию. У нас тоже. Делается при определенной ситуации. Когда у ребенка легочная недостаточность, низкая сатурация. В раннем возрасте открытый артериальный проток очень хорошо лечится. Время от рождения до 1-3 месяцев – это окно возможностей, когда можно увидеть большинство врожденных патологий сердца. И открытый артериальный проток в этом возрасте виден великолепно. В отличие от взрослых.
Откуда появляются взрослые с ОАП? Эхокардиография относительно недавно стала применяться настолько широко, лет 15. Так вот те взрослые, которые были недообследованы в свое время, у них может обнаружиться открытый артериальный проток. И у детей иногда в более старшем возрасте обнаруживают ОАП во время диспансерзации.
Когда оперируют открытый артериальный проток?
Если он крупный. Если приводит в выраженному нарушению гемодинамики – это проявляется в раннем периоде, и решение принимается в первые дни. Если по какой-то причине не потребовалось это, открытый артериальный проток небольшой по калибру, 1-2 мм, то такие протоки сразу не закрывют, а оставляют на потом, так как возможно они закроются сами, или медикаментозно. Оперативное вмешательство необходимо не всегда.
Насколько сложное это вмешательство? Насколько сложно ребенка реабилитировать после этого вмешательства?
Если рассматривать его из категории кардиохирургических вмешательств, оно считается несложным, это одна из самых простых операций. Если рассмтриваь просто из медицинских хирургических вмешательсв, нет ни одного вмешательсва, про которое можно было бы сказать, что это нечно простое. Наблюдая этот порок, если мы решаем, что его влияние на сердечно-сосудистую систему можно рассматривать как стабильное, то есть он гемодинамически не значимый, мы наблюдаем обычно проток до предшкольного возраста.
Как проходит операция?
Проток имеет достаточно сложное строение. Выходное отверстие – ствол легочной артерии – от него зависит влияние на состояние сердечно-сосудистой системы, он его калибрует. Есть ампула – это широкая часть со стороны аорты. И есть его длина – протяженность. Все эти три параметра заставляют нас подбирать тот или иной вид устройства для закрытия.
Есть много вариантов устройств, которые закрывают проток. Флиппер – вытянутая струна из металла с эффектом памяти, которая, попадая в организм, свертывается в сложную спираль и закрывает проток. Есть окклюдеры специально уже конфигурированные – они применяются для закрытия более сложных протоков.
Оперируют ОАП через небольшой разрез (традиционное ушивание) либо эндоваскуально, через бедренную артерию: делается прокол, проводится инструмент, который закрывает этот проток.
Что будет, если не закрывать открытый артериальный проток?
Достаточно часто встречаются маленькие открытые артериальные протоки, калибром до 1 мм или 1 мм с небольшим, гемодинамически они не значимые. Но есть одно но. Принято их закрывать не потому, что они играют такую большую роль в гемодинамике, а потому что в дальнейшем возможно развитие боталита.
Боталлит – это воспаление боталлового протока, которое может привести к определенным осложнениям. А имеенно к тромбозу, развитию вегетации. Это разрастание бактериальных колоний и возникает оно при тяжелой бактериальной инфекции: пневмониях разной этиологии, лор-инфекциях, тонзиллитах, пародонтитах. В этом лучае лечение становится достаточно неприятным, т.к. присоединяется тромбоз. Это уже не простая операция по имплантации оккклюдера, а это большая операция, которая заставляет нас иссекать область, где возникли эти вегетации, и лечение приоретает уже масштабность.
То есть в тех случаях, когда мы закрываем эти мелкие протоки, мы не влияем на гемодинамику, а мы как бы стелем себе соломку для того, чтобы не возникло этой сложной ситуации с боталитом. Это профилактика.
Вопрос от подписчиков. Родились на 34 неделе. Открытый проток 2 мм. Наблюдались до года и все-таки отправили на операцию. Других заболеваний нет. Не знаем, стоит ли еще ждать дошкольного возраста?
С такой истуацией встречаемся достаточно часто. Каждый конкретный случай надо рассматривать отдельно. Иногда приводят детей, у который 3 мм открытый артериальный проток. Но мы понимаем, что 3 мм были и в месяц, и это гемодинамически значимый проток. Как 3 мм оказались у него в 3-4-5 лет? И когда привозят, мы измеряем снова и оказалось, что меряют не там, где нужно. То есть не ту часть, которая калибрует сам проток и оказывает влияние на его значимость, а допустим, померили в средней части. Там действительно и 4, и 5 мм может быть. Но само соустье с легочной артерией – милимметр. Таким образом, этот проток гемодинамически не значим и спешить некуда.
Чем больше будет калибр сосуда, по которому мы будем проводить устройство, тем удобнее будет не только оператору, но и пациенту, потому что сосудистая стенка меньше будет травмироваться. Потому мы обычно сдвигаем это к 5-6 годам, если возможно. Если невозможно – это другая ситуация, тогда значит надо оперировать. Вплоть до того, что если нет возможности оперировать эндоваскулярно , значит, надо открытым способом. При показаниях, повторяюсь.
Каковы отдаленные последствия открытого артериального протока? Проявляется ли это как-то в дальнейшем?
Да, конечно. Одно из последствий – развитие боталлита. Вторая ситуация – это когда гемодинамически значимый проток по какой-то причине пропустили, такое тоже встречается. В этом случае в дальнейшем мы можем столкнуться с развитием легочной гипертензии. Избыточный объем крови, который будет попадать в малый круг кровообращения, приведет к повышению давления в нем, в итоге стенки сосудов, которые идут в легкие, уплотнятся. Сосуды становятся не способны к маневрам, именно к расширению, к сужению. И это так называемая легочная гипертензия. Четвертая стадия легочной гипертензии характеризуется тем, что человеку сложно помочь, он практически неоперабелен. Развивается синдром Эйзенменгера: как только мы уменьшим давление в малом круге кровообращения, это приведет к кризу малого круга кровообращения. Сосуды не способны работать при давлени более низком, чем было до этого. А с высоким давлением развивается отек легких. К сожалению, тут одно лечение только – это пересадка легких. Это очень тяжелая ситуация.
Поэтому ОАП надо обязательно наблюдать. В месяц-три месяца жизни ребенка – это окно возможностей, когда мы можем увидеть те нюансы, которые в более старшем возрасте мы по тем или иным причинам увидеть не сможем. Ребенка в год смотреть достаточно сложно. Маленькие дети в этом возрасте уже начинают осознавать себя и окружающих, и предъявлять им определенные требования. Они могут не захотеть спокойно лежать, они будут кричать, вырываться, а при крике исследовать очень сложно, потому что тот сигнал, который мы получаем, оказывается настолько зашумлен, что иногда невозможно ничего увидеть. А в месяц дети достаточно спокойны. По крайней мере, их можно покормить.
Каковы клинически значимые размеры протока?
Прямой корреляции между диаметром протока и клинической ситуацией нет. Зависит от многих факторов. Какой период жизни – новорожденности или более поздний период. Насколько зрелые легкие у ребенка. Очень много факторов. Но если 3 мм проток, то за ним очень внимательно наблюдают еще в роддоме. Просто так эхокардиографию в первые дни в роддоме мало кто делает. Дефицит специалистов, дефицит оборудования. Но вызывают обязательно специалиста даже из другого учреждения при клинической необходимости. Возникает она тогда, когда падает сатурация, когда диагностируется сердечно-легочная недостаточность.
А так, бывают ситуации разные: у меня на приеме была девочка, у которой в пять лет диаметр открытого артериального протока был 9 мм. У нее был синдром Эйзенменгера и помочь ей, к сожалению, мы не смогли. Был мальчик с похожей ситуацией. Но в современном мире это казуистика и быть такого по идее не должно. При ранней диагностике можно было помочь детям.
Какие риски есть у операций по установке окклюдера?
Риски при имплантации окклюдера минимальные. Для этого должен быть хороший диагност и специалист, который установит этот окклюдер должен работать с ним в тандеме.
У сына клипса в сердце. Нужно ли будет с ней что-то делать в дальнейшем?
Клипса титановая, и она остается в организме на всю жизнь. Вопросы возникают, когда собираются провести магнитно-резонансную томографию. Да, клипса из немагнитного материала титан. Но еамагнитные материалы в высоком магнитном поле нагреваются. Поэтому есть определенные ограничения. При исследовании МРТ считается, что если в организме есть разные металлические устройства (это стенты могут быть, например), в активной фазе исследования 15 минут можно находиться без вреда для здоровья.
У ребенка открытый артериальный проток, но не назначили никакого лечения. Нам 8 месяцев, родились на 31 неделе с весом 1650 граммов. Стоит ли показать ребенка другому врачу?
Второе мнение – это очень неплохо. Но поскольку размеры протока не обозначили, скорее всего этот проток гемодинамически незначимый, и врач решил, что надо понаблюдать. А медикаментозное лечение на даном этапе не обязательно. Если есть хоть малейшие сомнения, их надо решать.
Вы
–
руководитель отделения диагностических исследований. Насколько быстро развиваются технологии в этой сфере?
Так же, как и компьютеры. Развитие происходит параллельно. Миниатюризация, усложнение, увеличение диагностической уверенности. Если раньше было плохо видно и только диагност с опытом мог сказать что по определенным признакам что-то должно быть, то сейчас диагностическая уверенность больше, потому что и видно лучше, и ракурс можно более удобно подобрать. Потому что сами датчики, сами девайсы более удобные. Хотя опыт по-прежнему важен. Но можно при каких-то ситуациях, если ты не совсем уверен, назначить другое исследование.
Видео
Еще фото Автор (ы):
А.Н. ЛАПШИН, С.Г. АТАНАСОВА, Ю.В. СТРИЖАК, С.Н. ВЕРЕНИКИНА, Е.Л. КЕМЕЛЬМАН, М.Н. ЛАПШИН, В.Ю. ХВЕДЧУК, И.А. ТЮРЕНКОВ, П.В. БЕЛОКОПЫТОВ, С.К. СОБАКИНА, Т.В. ПИМЧЕНКО, А.В. КЛИМОВА
Организация(и):
Инновационный Ветеринарный Центр Московской ветеринарной академии
Журнал:
№6-2017 УДК: 619:616.624-089
Ключевые слова:
лечение открытого артериального протока, открытый артериальный проток, эндоваскулярное лечение, окклюзия ОАП, эмболизация ОАП
Key words:
patent ductus arteriosus, embolization of PDA, intervention Radiology
Аннотация
Персистирующий артериальный проток – один из наиболее частых врожденных дефектов сердечно-сосудистой системы у животных. В настоящее время эндоваскулярные технологии являются предпочтительными в лечении подобных пациентов.
Summary
Patent Ductus Arteriosus is 1 of most incidental congenital vascular anomaly of the heart. Now we have excellent treatment option like endovascular occlusion or how we call in embolization of PDA. This paper is focused on different types of embolization by transarterial approach.
Введение
Персистирующий артериальный проток – один из наиболее частых врожденных дефектов сердечно-сосудистой системы у животных (по данным Schrope). В настоящее время эндоваскулярные технологии являются предпочтительными в лечении подобных пациентов. При этом, с повышением количества подобных вмешательств, в мире важным также стал момент предоперационного определения морфологии и размеров открытого артериального протока (ОАП). Такие величины, как тип П-ОАП и минимальный диаметр протока (остриум ОАП), зачастую являются сложными при рутинной ТТ-ЭхоКГ и не определяются кардиологами. Ввиду этого фактора различные дополнительные методы визуализации применяются для типирования ОАП на предоперационном этапе. Основным применяемым методом для типирования является ТЭ-ЭхоКГ, однако в настоящий момент данная техника не применяется в РФ. По этой причине в своей практике мы применяем методику предоперационной КТ-А с максимальными возможными для 16-срезового компьютерного томографа значениями скорости вращения рентгеновской трубки и pitch-параметра. После типирования П-ОАП производится планирование операции и выбор техники доступа.
Большинство ветеринарных специалистов, выполняющих эндоваскулярные вмешательства при ОАП, предпочитают трансартериальный доступ через бедренную артерию, так как он наиболее прост с точки зрения позиционирования эмболизирующего девайса в полости ОАП.
Подготовка пациента
Диагноз ОАП устанавливается на основе данных физикального осмотра (аускультации) и ТТ-ЭхоКГ. При ультрасонографии сердца определяется направление тока крови в ОАП (лево-правый или право-левый сброс), определяются размеры камер сердца и дисфункции клапанов (митральная регургитация). Это позволяет определить, перспективно ли делать рекомендацию пациенту в хирургическом методе лечения либо помочь ему уже невозможно (нарушение сократимости камер сердца и/или наличие право-левого шунтирования).
Ввиду того, что выбор метода лечения пациента всецело лежит в области ответственности владельца животного, врач разъясняет все плюсы и минусы различных техник хирургической помощи. Ранее мы рекомендовали проведение КТА исключительно в случаях согласия владельцев на выполнение их питомцу эндоваскулярного лечения, но с появлением материала Dundie и соавт. о применении технологий 3D-печати в хирургическом планировании открытых операций возможности применения КТА могут быть существенно расширены.
Основная задача специалистов КТ при выполнении исследования – заставить томограф обогнать скорость сердечного толчка для получения наилучшей характеристики морфологии ОАП. Однако в полном объеме реализовать данную цель на 16-срезовом томографе не представляется возможным. В то же время у наших специалистов получается осуществлять хорошую визуализацию ОАП на максимальных параметрах сканирования, доступных аппарату (оборот трубки 0,6 с и pitch = 1,5), для последующих расчетов размера необходимого эмболизирующего девайса (рис. 1, 2).
Техника операции
Трансартериальная катетеризация через бедренную вену является наиболее простым способом доступа ввиду отсутствия необходимости «обратных» изгибов катетером, как при трансвенозном доступе. Необходимо отметить, что трансартериальный доступ может быть применен у пациентов весом более 3 кг. Выполняется диссекция правой или левой бедренной артерии. На дистальную часть выделенного участка бедренной артерии накладывается лигатура, а на проксимальный – турникет (рис. 3). Бедренная артерия пунктируется катетером 16G или рассекается в поперечном направлении. Далее в бедренную артерию вводится ангиографический проводник до уровня дуги аорты, что контролируется рентгеноскопически. По проводнику устанавливается интродьюсер или доставочное устройство (проводниковый катетер). При использовании катетера он по проводнику вводится на уровень дуги аорты. Выполняется первая ангиография и оценивается размер ампулы ОАП и остриума. По нашему опыту, скорость тока крови столь высока, что адекватная визуализация ОАП может быть затруднительна даже у малых пациентов и с параметром работы С-дуги – 30 кадров в секунду. Поэтому далее катетер подтягивается назад, и в этом движении он без труда попадает в полость ОАП. Ангиография непосредственно из полости ОАП позволяет получить лучшую картину минимального диаметра протока и ампулы. Далее проводник вводится через остриум в полость легочного ствола и по нему проводится катетер (рис. 4, 5).
Эмболизация спиралью
Традиционно для эмболизации ОАП спиралью применяются управляемые спирали семейства Flipper от СookMedical. Техника со спиралью может подойти пациентам с небольшой ампулой ОАП и остриумом не более 4 мм.
По катетеру в полость ствола легочной артерии выводят два витка спирали, затем спираль подтягивают к остриуму и три витка спирали открывают в ампуле ОАП (рис. 6–8). Затем проводится тест с тракцией спирали (спираль подтягивают к аорте и затем толкают в ствол легочной артерии), это позволяет определить устойчивость спирали и профилактирует инцидентность миграции эмболизирующего агента после имплантации. В момент точного позиционирования спирали мы просим анестезиолога разместить фонендоскоп под стерильным операционным бельем на уровне дуги аорты и провести аускультацию. При использовании эмболизирующей спирали аускультативный шум от ОАП затухает практически сразу же или становится на порядок тише. В этот момент кабель доставочного устройства от спирали откручивается, и спираль освобождается. Перед извлечением катетера выполняется контрольная ангиография, на которой отмечается либо отсутствие сброса крови в легочный ствол, либо минимальный сброс (рис. 9).
Эмболизация окклюдером
Наиболее часто в качестве окклюдера мы используем сосудистый плаг второго типа (Amplazer Vascular Plug 2). Девайс применялся ранее у животных до появления специального ветеринарного окклюдера (Amplazer Canine Ductual occluder). Важным в применении VP2 является соответствие диаметров доставочного устройства и окклюдера.
После подготовительных мероприятий с бедренной артерией (см. выше) доставочное устройство позиционируется в дуге аорте и далее сдвигается каудально и таким образом производится катетеризация. Ангиография проводится в полости ОАП, и минимальный диаметр протока (остриум) также высчитывается (рис. 10). Далее катетер проводится в просвет остриума. VP2 по форме напоминает три соединенных диска, и при позиционировании первый диск открывается в полости ствола легочной артерии, далее создается тракция на себя, и два остальных диска открываются в просвете ампулы ОАП (рис. 11,12). Обычно при использовании техники с окклюдером аускультативный шум от ОАП затухает в течение первых 10 мин, поэтому мы стараемся на протяжении этого времени не отсоединять кабель от окклюдера. Анестезиолог при этом проводит аускультацию на предмет затухания шума, когда шум становится неаускультируемым или еле слышным, проводится контрольная ангиография (рис. 13). При контрольной ангиографии зачастую не определяется значительного сброса контраста в легочный ствол. Далее проводится тест с тракцией окклюдера (подтягивание, чередующееся с толканием окклюдера), если окклюдер стоит устойчиво, то кабель отсоединяется (рис. 14). Далее все катетеры извлекаются, и бедренная артерия лигируется.
В послеоперационном периоде пациенту назначают антибактериальную терапию в течение 3–4 нед и рекомендуют не выполнять любых плановых операций в течение 3 мес. Данная тактика ранее являлась профилактикой развития бактериального эндокарита, однако в последнем исследовании Szatmári была проверена гипотеза об отсутствии необходимости в профилактической антибактериальной терапии в отношении имплантзависимого развития бактериального эндокардита, которая подтвердила отсутствие необходимости в данной профилактике.
Выводы
Трансартериальный доступ в эмболизации ОАП можно считать наиболее простой техникой, которая требует минимальных навыков в эндоваскулярной хирургии, но значительной подготовки перед процедурой и значительно большего внимания к предоперационному планированию. КТА, выполняемая во всех случаях эндоваскулярного лечения ОАП, помогает нам снизить возможность осложнений, связанных с миграцией эмболизирующего девайса при незначительном расхождении в высчитанных размерах по ТТ-ЭхоКГ, также исключить возможность отсутствия необходимого размера в линейке расходных материалов, которая есть в наличии. Стоит учитывать, что у собак весом более 3 кг, но менее 10 кг доступ через бедренную артерию может быть затруднительным ввиду ее размеров (минимальный размер бедренной артерии, позволяющий с ней работать, составляет 2,3 мм).
Примечание: с видеоматериалом, посвященным данной технике, можно ознакомиться на youtube.com канале Dr.AntonLapshin.
Авторы хотели бы выразить признательность специалистам-кардиологам из ветеринарных клиник Российской Федерации за то, что они доверяют жизни своих пациентов нашим рукам.
Литература
1. Dundie A. et al. Use of 3D printer technology to facilitate surgical correction of a complex vascular anomaly with esophageal entrapment in a in a dog. Journal of Veterinary Cardiology. 2021. https://dx.doi.org/10.1016/ j.jvc.2016.10.003
2. Nguyenba T. Amplazer canine duct occluder: A novel device for patent ductus arteriosus occlusion.
3. Schrope D.P. Prevalence of congenital heart disease in 76,301 mixed-breed dog sand 57,025 mixed-breed cats. JVetCardiol. 2015;17:192–202.
4. Szatmári V. Incidence of postoperative implant-related bacterial endocarditis in dogs that underwent trans-catheter embolization of a patent ductus arteriosus without intra- and post-procedural prophylactic antibiotics. Veterinary Microbiology. 2017;207:25–28.
5. Saunders A.B., Gordon S.G., Boggess M.M., et al. Long-term outcome in dogs with patent ductus arteriosus: 520 cases (1994–2009). J Vet Intern Med. 2014;28:401 –410.
6. Sanders R.A., Olivier N.B. Alternative methods for the measurement of the minimal ductal diameter of a patent ductus arteriosus in a dog. Journal of Veterinary Cardiology. 2021. https://dx.doi.org/10.1016/ j.jvc.2016.08.002