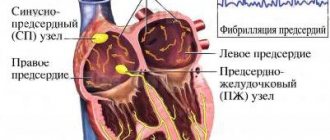
Представляем очередную статью нашего цикла публикаций, посвященного различным формам ИБС (ишемическая болезнь сердца). Сегодня мы поговорим об аритмиях.
Нарушения сердечного ритма и проводимости – это многочисленная группа преходящих или постоянных расстройств, в основном возникающих при органических поражениях сердечно-сосудистой системы. Они обусловлены нарушениями важнейших функций миокарда: автоматизма, возбудимости и проводимости.
Аритмии сердца – это собирательное понятие целого ряда различных нарушений частоты, ритмичности и последовательности сокращений сердца. Диагностика ишемической болезни сердца проводится с помощью ЭКГ..
Частота сердечного ритма у большинства здоровых людей в покое составляет 60–75 ударов в минуту.
Что такое фибрилляция предсердий?
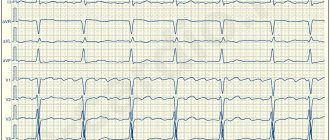
Фибрилляция предсердий — самый распространенный вид аритмии, при котором предсердия сокращаются хаотично и нерегулярно.
Синусовый узел, располагающийся в правом предсердии, продуцирует импульс частотой 60-80 в минуту, который передается по всей проводящей системе сердца. Орган сокращается, образуя синусовый ритм. При фибрилляции предсердий в них возникает много очагов электровозбуждения, в результате чего предсердие очень быстро сокращается, и в этот момент синусовый узел не работает. Пароксизмы (эпизоды) ФП могут быть короткими и бессимптомными, а могут продолжаться несколько дней или месяцев. ФП сама по себе не опасна, но в трети всех случаев приводит к развитию ишемического инсульта.
Чем опасна фибрилляция предсердий?
Среднестатистический российский пациент с фибрилляцией предсердий — это человек 72 лет с ишемической болезнью сердца. Сама по себе ФП не является угрожающим жизни состоянием, но может привести к развитию тяжелой клинической ситуации.
Ишемический инсульт 75% всех инсультов — это ишемические инсульты. Каждый третий ишемический инсульт случается в результате ФП. Как это происходит? При фибрилляции предсердий кровь в сердце имеет турбулентный ход, в левом предсердии возникает тромбоз. Этот тромб забивает сосуды и вызывает инфаркт головного мозга.
Инфаркт миокарда 6 из 10 пациентов с ФП имеют в анамнезе ишемическую болезнь сердца. Если есть ФП и ИБС, то риск развития инфаркта миокарда увеличивается в 5 раз.
Инвалидность и смерть Европейские исследования, основанные на данных 4000 пациентов, показали, что каждый третий человек, перенесший ишемический инсульт на фоне ФП и не принимавший антикоагулянты, умирал в течение трех месяцев. Исследование показало повышение риска инвалидизации на 43%, это происходит из-за длительной реабилитации.
| В 2020-м году Европейское общество кардиологов выработало ABC- алгоритм действий при фибрилляции предсердий: А — антикоагулянты В — контроль частоты сердечных сокращений С — контроль образа жизни человека |
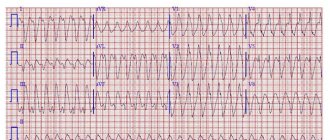
Симптомы фибрилляции желудочков
Сложно говорить о каких-либо симптомах фибрилляции желудочков, потому что происходит быстрое и внезапное прекращение кровообращения, что связано в первую очередь с потерей сознания и остановкой дыхания. Только в крайнем случае эта проблема исчезает сама по себе. Для большинства необходимо принять меры по реанимации. Если дыхание восстановится, больной может выжить, если не оказать помощь, он умирает. Ключевое значение здесь имеет правило «четырех золотых минут». Именно оно определяет жизнь или смерть пациента.
Как узнать, что у меня фибрилляция предсердий?
Самые частые симптомы ФП — чувство сердцебиения, одышка и общая слабость. Не стоит доверять субъективным ощущениям — необходимо сделать кардиограмму или провести суточный мониторинг ЭКГ по Холтеру.
Холтер поможет более точно определить наличие пароксизмов. Если пароксизм длится от 30 секунд — можно обращаться к врачу за антикоагулянтами. В сутки проходит 40 тысяч сердечных сокращений, из них может быть 400 экстрасистол (сердцебиений вне ритма) — это норма.
Бывает что человек не ощущает пароксизмы — к примеру, когда они случаются ночью. Это плохо, потому что могут образовываться небольшие тромбы, которые будут закупоривать мелкие сосуды головного мозга. Нарушение кровоснабжения некоторых участков приведет к их отмиранию, что значительно повышает риск развития деменции.
У молодых людей экстрасистолы могут иметь внесердечные причины — необходимо проверить показатели ферритина, гемоглобина, гормонов щитовидной железы, исследовать желудочно-кишечный тракт с целью исключения рефлюкса-эзофагита, который также вызывает срывы ритма, в том числе и фибрилляцию предсердий. Людям с ФП раз необходимо в 6 месяцев сдавать анализы показателей печени, почек, общий анализ крови.
| Существует три формы фибрилляции предсердий: — Постоянная форма — Персистирующая форма (ФП проходит с медицинской помощью) — Пароксизмальная форма (ФП появляется и проходит самостоятельно) |
Состояние до фибрилляции желудочков
Обычно фибрилляция желудочков инициируется другими аномалиями, поэтому нельзя игнорировать любые симптомы, и ЭКГ сердца должна быть ежегодным контрольным обследованием у взрослых. Существует так называемое дополнительное возбуждение желудочков, которое следует через определенное время после сокращения желудочков – феномен R на T. За ним следует дегенерация желудочковой тахикардии или фибрилляция предсердий. На электрокардиографии феномен R на T проявляется на ЭКГ, на которой зубец R находится рядом с зубцом T. Значительные изменения в записи видны после снятия ЭКГ. Запись представляет собой неправильную синусоиду.
В исходном состоянии, когда появляется правильная форма и частота действия находится в пределах 200-300 ударов в минуту, говорят о трепетании желудочков. В ситуации, когда синусоидальная волна нерегулярна, а импульсы имеют переменную амплитуду, речь идет о фибрилляции желудочков. В этом случае количество стимуляций в минуту может достигать 600 ударов. Одно можно сказать наверняка, это состояние – прямая угроза жизни. И хотя само расстройство возникает внезапно, и человек не может на него повлиять, профилактика, надлежащий уход за собой и проверка здоровья не реже одного раза в год имеют ключевое значение. Болезнь лучше предотвратить, чем лечить.
Главные препараты для профилактики инсульта при ФП — это антикоагулянты
Главные препараты для пациентов с ФП, профилактирующие инсульт, — антикоагулянты, воздействие которых снижает свертываемость крови. Они предотвращают образование тромбов и следовательно, снижают риск развития инсульта. Свертываемость является нормальной защитной реакцией организма на повреждение сосудистой стенки. При фибрилляции предсердий антикоагулянты принимать абсолютно необходимо практически всем.
Самые известные в России антикоагулянты — «Эликвис», «Ксарелто» и «Прадакса».
Также некоторым пациентам можно принимать «Варфарин» (с контролем МНО). Его назначают при низкой скорости клубочковой фильтрации (или клиренса креатинина — показателя работы почек) или при протезированных клапанах.
Принимая «Варфарин», необходимо контролировать МНО в крови (Международное Нормализованное Отношение) — показатель должен быть от 2.0 до 3.0.
| Главные препараты для пациентов с ФП, профилактирующие инсульт — антикоагулянты, воздействие которых снижает свертываемость крови. При фибрилляции предсердий антикоагулянты принимать абсолютно необходимо практически всем. |
Дефибрилляция
Проводится при перечисленных ниже нарушениях ритма. При проведении сердечно-легочной реанимации дефибрилляция при указанных нарушениях ритма должна быть выполнена как можно раньше. Если с момента фатального нарушения ритма сердца прошло более 3 минут, дефибрилляции должен предшествовать непрямой массаж сердца.
Дети: начальная мощность приблизительно 2 Дж/кг массы тела, повторная дефибрилляция – 4 Дж/кг массы тела.
Противопоказания: отказ от реанимационных мероприятий.
| Показания для проведения дефибрилляции и рекомендуемая начальная мощность разряда для взрослых пациентов: | |||
| Вид аритмии | Мощность импульса в джоулях (Дж) | ||
| монофазный | бифазный | ||
| Фибрилляция желудочков | 360 Дж или максимальной мощности | 150-200 Дж | |
| Полиморфная желудочковая тахикардия | 360 Дж или максимальной мощности | 150-200 Дж | |
| Желудочковая тахикардия без пульса | 360 Дж или максимальной мощности | 150-200 Дж | |
Принимать антикоагулянты можно только по назначению врача
Стандартная дозировка: «Ксарелто» 20 мг / 1 раз в день «Эликвис» 5 мг / 2 раза в день «Прадакса» 150 мг / 2 раза в день
Исследования показывают, что пациентам удобнее принимать «Ксарелто» — прием 1 раз в день легче запомнить, особенно пожилым людям.
«Вафарин»: пить по одной таблетке вечером, через 3–4 дня сдать МНО. Если МНО не достигло 2.0, то доктор должен увеличить дозировку. МНО следует сдавать раз в 3–4 дня, пока нужный уровень не будет достигнут. Затем нужно сдавать МНО раз в 3 недели.
Важно: все препараты и их дозировка назначаются строго на очном приеме у врача! Данная информация носит ознакомительный характер и не может быть руководством к действию. Самолечение при аритмии недопустимо и может иметь серьезные последствия для здоровья.
| Снижение дозировки антикоагулянтов в основном зависит только от трех параметров: — Показатель клиренс-креатинина меньше 50. — Вес пациента меньше 65 кг. — Возраст пациента больше 85 лет. В остальных случаях снижение дозировки грозит риском инсульта. |
Антикоагулянты разжижают кровь — это опасно?
Как и любые кроворазжижающие препараты, антикоагулянты могут вызвать кровотечение. Однако, риск кровотечения в 10 раз ниже риска инсульта. Если у человека спонтанные синяки, кровь из носа, обильные менструации, кровь в моче — это не показатель того, что нужно снижать дозировку. От мелких кровотечений не умирают, в отличие от инсульта. При вышеуказанных симптомах кровотечений нужно прийти на осмотр к лечащему врачу — гинекологу, урологу и, обязательно, к кардиологу.
| Если человек принимает антикоагулянты, он должен раз в 6 месяцев сдавать общий анализ крови, креатинин, скорость клубочковой фильтрации (клиренс–креатинин), калий, натрий, АЛТ, АСТ. |
Опасные или бесполезные препараты
● 50% инсультов при ФП связано с тем, что человек принимает аспирин. Ни аспирин, ни «Клопидогрел», ни их комбинация, не защищают человека от развития ишемического инсульта. ● Многие пьют кровь-разжижающие препараты, когда к этому нет причин, другие готовы заменять антикоагулянты «Кардиомагнилом», «Милдронатом», «Рибоксином» — так делать нельзя. ● «Предуктал» может вызвать экстрасистолию и усилить аритмию, его применяют только при ишемической болезни сердца. ● Сердце ничем нельзя «попитать», не существует «витаминов для сердца». Сердце это отражение вашего образа жизни — питание, движение, сон.
Почему нужно контролировать образ жизни?
Потому что он отражается на размере левого предсердия. Чем выраженнее ожирение, тем размер левого предсердия выше. Если у человека есть лишний вес, давление в сердце увеличивается, увеличивается объем циркулирующей крови, растягивается левое предсердие. Чем больше левое предсердие от нормы (400 мм), тем выше риск развития фибрилляции предсердий.
Ситуации
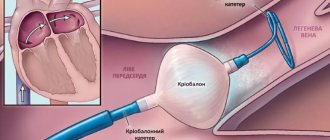
При нормальном размере левого предсердия эффективность радиочастотной абляции может достигать 70%. Чем больше размер левого предсердия, тем эффективность РЧА ниже.
● Если пациент проходит радиочастотную абляцию, важно помнить: чем больше отклонений от нормы в работе предсердия, тем выше риск рецедива мерцательной аритмии. ● Когда у человека сбивается сердечный ритм, во время проведения УЗИ обращают внимание на размер левого предсердия: если оно незначительно расширено, имеет смысл попытаться восстановить этот ритм с помощью медикаментозных методов или электроимпульсной терапии. Но если левое предсердие значительно расширено, особого толка восстанавливать ритм нет — рано или поздно он опять сорвется.
Что делать?
● Контролировать вес. ● Отказаться от алкоголя — алкоголь увеличивает риск кровотечения и утяжеляет течение аритмии либо увеличивает частоту срывов этой аритмии. ● Отказаться от курения. ● Отказаться от приема БАДов — большинство из них может усилить действие антикоагулянтов. ● Увеличить физические нагрузки. ● Контролировать состояние щитовидной железы у эндокринолога.
Лечение больных с желудочковыми аритмиями
Т
ермином «желудочковые эктопические аритмии» обозначают единичные и групповые желудочковые комплексы, исходящие из очагов, расположенных ниже бифуркации пучка Гиса.
Классификация
Желудочковые эктопические аритмии разделяют на 3 основные категории: экстрасистолия, или преждевременные желудочковые сокращения; желудочковая тахикардия; трепетание и фибрилляция желудочков.
Желудочковыми экстрасистолами называют единичные или парные комплексы, исходящие из желудочков. В течение многих лет кардиологи широко использовали предложенную B. Lown и M. Wolf [1] классификацию, подразделяющую желудочковые экстрасистолы на пять градаций: редкие изолированные; частые (более 1 в мин.); полиморфные; групповые; ранние. Позднее была предложена и в настоящее время получила распространение модифицированная классификация [2], предполагающая разделение желудочковых аритмий по их форме и частоте экстрасистол
(табл. 1). Предложена также специальная классификация желудочковой тахикардии [2].
По продолжительности эпизодов различают
залповую, нестойкую и стойкую формы, а
по морфологии
желудочковых комплексов на ЭКГ выделяют тахикардию мономорфную, полиморфную, «пируэтную», двунаправленную и исходящую из пути оттока правого желудочка.
Клиническое значение
Известно, что возрастание градаций желудочковых аритмий у больных с органическим поражением сердца и снижением его насосной функции сопряжено с увеличением риска внезапной аритмической смерти [1, 3, 4]. В связи с этим T. Bigger [4] предложил различать три категории желудочковых аритмий:
доброкачественные, потенциально злокачественные, злокачественные. Доброкачественными он считает экстрасистолы, вне зависимости от их градации, возникающие у лиц без органического поражения сердца. Такие экстрасистолы не влияют на жизненный прогноз. К потенциально злокачественным автор относит желудочковые экстрасистолы, возникающие с частотой более 10 в минуту у больных, имеющих органическое заболевание сердца со снижением сократительности левого желудочка. К злокачественным он относит пароксизмы стойкой желудочковой тахикардии, эпизоды фибрилляции желудочков, устраненные с помощью реанимационных мероприятий у больных с органическими заболеваниями сердца, особенно со снижением функции выброса левого желудочка менее 40%.
Сочетание желудочковых аритмий высоких градаций и снижения сократительности левого желудочка значительно повышает риск внезапной аритмической смерти
. У больных ишемической болезнью сердца, у которых внезапная смерть наступает более часто, имеется еще один важный фактор риска: острая ишемия миокарда, составляющая с двумя вышеназванными так называемый треугольник риска внезапной аритмической смерти [5]. Соотношение вышеназванных факторов риска представлено схематически на рисунке 1.
Известно, что возрастание градаций желудочковых аритмий у больных с органическим поражением сердца и снижением его насосной функции сопряжено с увеличением риска внезапной аритмической смерти [1, 3, 4]. В связи с этим T. Bigger [4] предложил различать доброкачественные, потенциально злокачественные, злокачественные. Доброкачественными он считает экстрасистолы, вне зависимости от их градации, возникающие у лиц без органического поражения сердца. Такие экстрасистолы не влияют на жизненный прогноз. К потенциально злокачественным автор относит желудочковые экстрасистолы, возникающие с частотой более 10 в минуту у больных, имеющих органическое заболевание сердца со снижением сократительности левого желудочка. К злокачественным он относит пароксизмы стойкой желудочковой тахикардии, эпизоды фибрилляции желудочков, устраненные с помощью реанимационных мероприятий у больных с органическими заболеваниями сердца, особенно со снижением функции выброса левого желудочка менее 40%. . У больных ишемической болезнью сердца, у которых внезапная смерть наступает более часто, имеется еще один важный фактор риска: острая ишемия миокарда, составляющая с двумя вышеназванными так называемый треугольник риска внезапной аритмической смерти [5]. Соотношение вышеназванных факторов риска представлено схематически на рисунке 1.
Рис. 1. Факторы риска внезапной аритмической смерти у больных ИБС
Желудочковые аритмии высоких градаций являются важнейшим признаком электрической нестабильности миокарда. Другими известными маркерами этого состояния могут служить нарушения вегетативной регуляции сердечного ритма с преобладанием симпатической активности, что проявляется снижением вариабельности синусового ритма и барорецепторной чувствительности [6, 7], увеличением продолжительности и дисперсии интервала QT [8], а также появление поздних желудочковых потенциалов, регистрируемых с помощью ЭКГ высокого разрешения [9]. Изменение дисперсии интервала QT и выявление поздних желудочковых потенциалов имеют малую специфичность при выявлении лиц с повышенным риском внезапной аритмической смерти.
Основные факторы риска внезапной аритмической смерти, их клинические проявления и методы выявления у больных ИБС представлены в таблице 2. Вопрос о факторах риска, методах их выявления и подходах к профилактике внезапной смерти был подробно изложен в одной из наших предыдущих работ [10].
Лечение
Говоря о тактике лечения аритмий сердца вообще и желудочковых аритмий, в частности, необходимо прежде всего отметить, что они далеко не всегда требуют специальной терапии. Лечения в первую очередь требуют злокачественные и потенциально злокачественные аритмии. Существуют три показания к назначению антиаритмической терапии:
неблагоприятное прогностическое значение аритмии; негативное влияние аритмии на гемодинамику; плохая субъективная переносимость аритмии.
Говоря о тактике лечения аритмий сердца вообще и желудочковых аритмий, в частности, необходимо прежде всего отметить, что они далеко не всегда требуют специальной терапии. Лечения в первую очередь требуют злокачественные и потенциально злокачественные аритмии. Существуют неблагоприятное прогностическое значение аритмии; негативное влияние аритмии на гемодинамику; плохая субъективная переносимость аритмии.
Очень распространена ошибочная врачебная тактика, заключающаяся в неоправданно агрессивном назначении антиаритмических средств для лечения доброкачественных аритмий. Такая тактика может нанести большой вред пациенту, т.к. большинство антиаритмических препаратов обладает серьезными побочными действиями, длительное использование некоторых из них может негативно влиять на жизненный прогноз. Существенным негативным последствием такой тактики является то, что пациент, который ранее не обращал большого внимания на сердечные ощущения, видя то внимание, которое врач уделяет лечению аритмии, начинает прислушиваться к работе своего сердца, постоянно проверяет пульс и считает себя серьезно больным, что далеко не всегда соответствует действительности. Другой ошибкой является благодушное отношение к аритмиям, реально требующим адекватной терапии. Поэтому первым вопросом, на который врач должен ответить, обследовав больного с аритмией – это вопрос о необходимости и целесообразности антиаритмической терапии и цели последней. Задачами такой терапии являются не только и не сколько полное устранение аритмии (что часто нереально), сколько улучшение прогноза и качества жизни больного.
Стремясь устранить аритмию, необходимо в первую очередь иметь в виду ее этиологию, т.е. лежащее в основе заболевание. В некоторых случаях этиотропной терапии бывает достаточно для того чтобы аритмия перестала быть терапевтической проблемой. Помимо этого, при обследовании больного необходимо выявить патогенетические факторы и условия, способствующие возникновению и прекращению аритмии, например, психоэмоциональные реакции, физическое напряжение, парасимпатические влияния, нарушения электролитного баланса, интоксикации, аритмогенное действие медикаментов и др. Устранение этих факторов может играть важную роль в лечении аритмий. Так, у лиц без органического заболевания сердца, которые имеют субъективно плохо переносимую желудочковую экстрасистолию, можно с успехом использовать психотропные препараты, при наклонности к брадикардии – холинолитические средства, при нарушениях электролитного баланса – препараты калия и магния.
Вопрос о применении антиаритмических препаратов для лечения желудочковых аритмий у больных с органической патологией сердца весьма сложен и имеет много противоречивых аспектов. Наибольшее распространение получило изучение результатов использования антиаритмиков, основанное на классификации E.M. Vanghan Williams в модификации J.C. Harrison [11], хотя известно, что многие антиаритмики обладают свойствами не одного, а нескольких классов, и отнесение их по преимущественному действию к одной из групп весьма условно.
Наиболее изучены результаты применения антиаритмических средств у больных, перенесших инфаркт миокарда. Широко известные исследования CAST–I
и
CAST– II
показали, что подавление желудочковых экстрасистол с помощью препаратов I С класса флекаинида, энкаинида и морицизина приводило к значительному повышению риска внезапной и общей смертности [12]. Негативное влияние на жизненный прогноз постинфарктных больных было отмечено при использовании препаратов класса I А и I В [13]. Следует заметить, что во всех исследованиях, показавших негативное влияние антиаритмиков I класса на жизненный прогноз, эти препараты давались длительно, непрерывно и в больших дозах. Однако при ретроспективном анализе результатов исследований CAST было о подавление желудочковых экстрасистол малыми дозами антиаритмиков может способствовать снижению риска внезапной смерти [14]. Антиаритмические препараты I класса можно без опасения использовать для лечения желудочковых аритмий у больных с некоронарогенными заболеваниями миокарда, не сопровождающимися выраженным снижением сократительности миокарда. Среди этих препаратов в нашей стране распространены
этацизин
,
аллапинин
[15] и
пропафенон
[16].
Значительную роль в лечении желудочковых аритмий могут играть блокаторы адренергических b–рецепторов
. Многочисленные рандомизированные клинические исследования показали, что b–адреноблокаторы, не обладающие собственной симпатомиметической активностью, в том числе кардиоселективные, могут существенно снижать летальность постинфарктных больных, в частности, частоту внезапной смерти [13, 17]. При этом отмечено, что снижение летальности далеко не всегда совпадает с устранением желудочковых аритмий и может быть обусловлено не столько антиаритмическим, сколько антиадренергическим, антиангинальным и другими эффектами. Имеются данные о том, что сочетанная терапия b–адреноблокаторами и антиаритмиками I С класса в исследованиях CAST привела к снижению летальности постинфарктных больных [18]. Рандомизированное клиническое исследование CIBIS–II показало, что использование кардиоселективного b–адреноблокатора
бисопролола
у больных с сердечной недостаточностью различной природы способствует снижению летальности и подавлению злокачественных желудочковых аритмий [19]. Известно, что препараты этого класса могут с успехом использоваться для лечения желудочковых аритмий при некоронарогеных заболеваниях сердца, в частности, сопровождающихся гипертрофией левого желудочка, дистрофиях миокарда различного генеза, а также при идиопатических аритмиях.
Что касается препаратов IV–го класса (блокаторов кальциевых каналов), то они, как правило, малоэффективны для лечения желудочковых аритмий, за исключением редких случаев желудочковой тахикардии, чувствительной к верапамилу [20].
Важную роль в речении желудочковых аритмий играют препараты III–го класса (блокаторы калиевых каналов, замедляющие реполяризацию). Существуют так называемые «чистые» блокаторы калиевых каналов, например, дофетилид, ибутилид, азимилид и др., которые в России пока еще не вошли в клиническую практику, и препараты, обладающие, помимо способности замедлять реполяризацию, свойствами других классов. К последним, в частности, относится соталол
(имеется в виду получивший распространение d/l – соталол) и
амиодарон
.
Соталол обладает свойствами неселективного b–адреноблокатора. Имеется ряд сообщений по результатам рандомизированных исследований, показавших высокую эффективность этого препарата при лечении и профилактике желудочковых аритмий, причем антиаритмическая эффективность и выживаемость больных была выше, чем при использовании препаратов I–го класса [21, 22]. Однако исследования с использованием соталола показали довольно высокую частоту побочных действий, в частности, аритмогенного эффекта, вероятность которого возрастает с увеличением дозы препарата [23].
Роль амиодарона
Наибольшее распространение среди антиаритмических препаратов в настоящее время имеет амиодарон. Как и другие препараты III–го класса, он способен блокировать калиевые каналы и удлинять потенциал действия, замедляя реполяризацию. Помимо этого, препарат инактивирует быстрые натриевые каналы, подобно антиаритмикам I–го класса, а также может блокировать медленные кальциевые каналы, как препараты IV класса. Амиодарон оказывает также неконкурентное ингибирующее действие на a– и b–адренорецепторы, т.е. обладает симпатолитическим эффектом. Таким образом амиодарон имеет свойства всех четырех классов антиаритмических препаратов. Значительную роль в антиаритмическом действии амиодарона играют его способность тормозить синтез в щитовидной железе тироксина и превращение последнего в трийодтиронин.
Амиодарон уменьшает потребность миокарда в кислороде и вызывает расширение коронарных артерий, что обусловливает антиангинальный эффект препарата. В отличие от большинства антиаритмиков отрицательное инотропное действие амиодарона незначительно. Амиодарон медленно всасывается в желудочно–кишечном тракте и связывается с белками плазмы. Максимальная концентрация амиодарона в плазме достигается через несколько часов после приема. Препарат депонируется в жировой ткани, скелетных мышцах, печени в других органах. Период полувыведения амиодарона может колебаться от нескольких недель до трех месяцев. Это свойство обусловливает медленное начало и большую длительность действия амиодарона. Антиаритмический эффект препарата при внутривенном введении достигает максимума только через несколько часов, а при приеме внутрь начинается через 2–3 дня и достигает максимума через несколько недель. После прекращения приема амиодарона действие его может продолжаться еще несколько недель [24].
Несмотря на то, что высокая антиаритмическая эффективность амиодарона известна с начала 70–х годов, широкое распространение этот препарат получил лишь в 90–х годах, когда стали известны результаты рандомизированных исследований, показавших возможность негативного влияния антиаритмиков I–го класса на жизненный прогноз, а также исследований, выявивших способность амиодарона снижать смертность постинфарктных больных. Такие ценные свойства препарата, как низкая частота аритмогенного эффекта и отсутствие выраженного отрицательного инотропного действия, наряду с высокой эффективностью, вывели амиодарон на первое место по частоте назначаемости среди всех антиаритмиков.
Хорошо известна высокая эффективность амиодарона при купировании и профилактике рецидивов мерцания и трепетания предсердий. По сводным данным семи рандомизированных исследований, купирующая эффективность внутривенного введения амиодарона при пароксизмах мерцания и трепетания предсердий составляет в среднем 66,5%, не уступая пропафенону, новокаинамиду, дизопирамиду и другим препаратам [25].
Еще более эффективен амиодарон при профилактике рецидивов мерцания предсердий. По данным завершившегося в 2000 году канадского сравнительного исследования [26], амиодарон по профилактической эффективности при данной аритмии стоит на первом месте, превосходя пропафенон и соталол.
Амиодарон высоко эффективен для купирования и профилактики узловой реципрокной тахикардии и приступов тахикардии у больных с синдромом преждевременного возбуждения желудочков.
Препарат является одним из наиболее эффективных препаратов для лечения желудочковой экстрасистолии различного генеза, однако, учитывая достаточно высокую частоту нежелательных эффектов при длительном приеме (см. ниже), этот препарат целесообразно назначать в основном при злокачественных формах аритмии, резистентных к антиаритмическим препаратам других классов [27].
Амиодарон при внутривенном введении может купировать пароксизмы желудочковой тахикардии [28]. Учитывая медленное действие препарата, использовать его лучше не как начальное средство, а в случаях, резистентных к терапии лидокаином и другими препаратами I–го класса.
Наибольшую значимость имеет использование амиодарона для профилактики угрожающих жизни желудочковых аритмий
. Как уже указывалось выше, под этим понятием подразумеваются желудочковые аритмии высоких градаций (табл. 1) у больных со сниженной фракцией выброса левого желудочка, а также первичная фибрилляция желудочков. В 1993 году были опубликованы результаты исследования
CASCADE
[29], которое оценивало выживаемость больных, реанимированных после первичной фибрилляции желудочков, на фоне терапии амиодароном или антиаритмиками I–го класса (хинидином, новокаинамидом, флекаинидом). Результаты этого исследования показали, что профилактическая эффективность амиодарона была значительно и достоверно выше по сравнению с препаратами I–го класса. Это проявилось более высокой выживаемостью больных и меньшей частотой рецидивирования аритмий. В 90–х годах было проведено большое число рандомизированных исследований влияния амиодарона на выживаемость постинфарктных больных с повышенным риском внезапной смерти, в частности,
BASIS
[30],
CAMIAT
[31],
EMIAT
[32] и др. Их результаты показали достоверное снижение частоты внезапной смерти при лечении амиодароном.
Несколько рандомизированных исследований было посвящено изучению применения амиодарона у больных с недостаточностью кровообращения различной этиологии. В частности, результаты аргентинского исследования GESICA
[33] показали, что в группе больных, леченных амиодароном, как общая, так и внезапная смертность была достоверно ниже, чем в контрольной группе. В другом рандомизированном исследовании
CHF–STAT
[34] общая смертность в группе леченных амиодароном была ниже, но не достоверно, в этой группе было отмечено снижение числа желудочковых экстрасистол. Недавно были опубликованы обобщенные результаты двух метаанализов большого числа рандомизированных исследований по применению амиодарона у больных с повторным риском внезапной смерти. В одном из них L. Sim и соавт. [35] по обобщенным данным 15 исследований отметили достоверное снижение внезапной и общей смертности при лечении амиодароном в группах больных инфарктом миокарда с дисфункцией левого желудочка и переживших остановку кровообращения. В исследовании
ATMA
[36] по результатам 13 рандомизированных исследований больных инфарктом миокарда и больных с сердечной недостаточностью с потенциально злокачественными желудочковыми аритмиями было отмечено, что применение амиодарона приводит к достоверному снижению риска как аритмической смерти, так и смерти от всех причин. Данные этого метаанализа подтвердили также положение о том, что добавление b–адреноблокаторов к амиодарону ведет к дополнительному снижению риска смерти. Во всех указанных исследованиях амиодарон использовался в малых и умеренных дозах. При попытке использования в одном из исследований [37] больших (более 1000 мг в сутки) доз препарата в виде длительного приема, было отмечено увеличение летальности по сравнению с контрольной группой, в связи с чем исследование было прекращено.
Обобщая результаты указанных исследований с использованием амиодарона, можно констатировать, что этот препарат на сегодняшний день является самым эффективным и безопасным среди антиаритмиков у больных с высоким риском внезапной смерти.
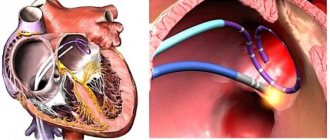
В последние годы в клиническую практику все шире входит имплантация кардиовертеров–дефибрилляторов
(ICD) для снижения риска смерти больных со злокачественными желудочковыми аритмиями. Анализ опубликованных в настоящее время результатов исследований по сравнению эффективности этого метода с лечением амиодароном [38–41], хотя и свидетельствует в целом о большей эффективности ICD, но дает противоречивые результаты и не позволяет однозначно рекомендовать данный метод, как средство выбора для профилактики внезапной смерти. Возможна и комбинированная терапия с помощью ICD и антиаритмических препаратов, в частности амиодарона, однако при этом могут возникать сложные проблемы взаимодействия аппарата и медикаментов [42], которые еще недостаточно изучены.
Побочные действия амиодарона
Возможности при лечении амиодароном в определенной степени ограничены его нежелательными действиями, которые чаще наблюдаются при использовании высоких доз препарата [24, 27, 36]. Наиболее серьезным из них является развитие «пируэтной» желудочковой тахикардии, способной трансформироваться в фибрилляцию желудочков (приобретенный синдром удлинения интервала QT). Данная аритмия может наступать при быстром насыщении высокими дозами амиодарона или при комбинации последнего с другими антиаритмиками, замедляющими реполяризацию желудочков. Возможны и другие аритмогенные эффекты, в частности, увеличение частоты имеющихся ранее или возникновение новых желудочковых аритмий. Аритмогенное действие амиодарона проявляется значительно реже, чем при применении других антиаритмиков, в частности, III–го и I–го классов. При применении амиодарона в низких дозах частота аритмогенных эффектов, по данным различных авторов колеблется от 1 до 5%. Нередко основанием для прекращения или перерыва в приеме амиодарона служит развитие выраженной синусовой брадикардии, синоатриальной или атриовентрикулярной блокады. По данным исследования ATMA
[36], брадикардия обусловливает отмену препарата в 2,4% случаев.
Из экстракардиальных побочных действий наиболее серьезным является интерстициальный пневмонит или фиброз легких, который развивается при длительном приеме высоких доз препарата с частотой до 1%.
Одним из наиболее частых побочных эффектов амиодарона является нарушение функции щитовидной железы. При длительном приеме препарата приблизительно у 5% больных развивается гипо– или гипертиреоз. Больным с нарушением функции щитовидной железы амиодарон назначать не следует.
При длительном непрерывном приеме амиодарона у 1–6% развивается пигментация кожи, чаще серо–зеленоватого оттенка, сопровождающаяся изменением фотосенсибилизации и повышением чувствительности к солнечным лучам. Продолжительное лечение этим препаратом может вызвать пигментные отложения в эпителии роговицы, что изредка приводит к незначительным зрительным нарушениям.
Из других побочных действий амиодарона следует отметить развивающиеся у небольшого процента больных тошноту, головную боль, бессонницу, реже – другие неврологические расстройства. У части больных повышается активность печеночных ферментов, хотя клинические проявления дисфункции печени наблюдаются редко. Амиодарон способствует повышению дигиталиса в плазме. В связи с этим при одновременном назначении амиодарона и препаратов дигиталиса дозы последних должны быть уменьшены.
Следует еще раз подчеркнуть, что почти все перечисленные побочные действия обычно наблюдаются при длительном использовании высоких доз амиодарона. При более осторожном назначении препарата в поддерживающей дозе до 200 мг в сутки с перерывами риск развития нежелательных эффектов значительно снижается.
Тактика лечения аритмий
Из изложенного вытекает необходимость соблюдать осторожность при назначении амиодарона, как и других антиаритмиков. Хотелось бы предостеречь врачей от недостаточно обоснованного назначения этих препаратов, что, к сожалению, нередко имеет место. Для подбора терапии больных с доброкачественными аритмиями возможен эмпирический подход. При аритмиях злокачественных для подбора и оценки эффективности лечения необходимо использовать метод холтеровского мониторирования ЭКГ, а также электрофизиологическое исследование сердца
.
Хотелось бы предостеречь от необоснованного назначения высоких доз антиаритмиков, т.к. при этом значительно возрастает риск побочных эффектов. Необходимо подбирать минимальные эффективные дозы. В частности, применение высоких доз амиодарона можно считать оправданным лишь при купировании опасных аритмий. При пароксизмах желудочковой тахикардии этот препарат вводят струйно по 150 мг, а затем капельно в течение нескольких часов в суммарной суточной дозе около 1000 мг. При пероральном приеме купирующая суточная доза амиодарона может составлять до 2000 мг. При стойких аритмиях лечение амиодароном начинают с дозы 400–800 мг в сутки в течение нескольких дней, а затем переходят на поддерживающие дозы. Наиболее распространена схема, по которой для поддержания эффекта препарат назначают по 200 мг в сутки 5 дней в неделю.
Достигнув желаемого результата при доброкачественных аритмиях, прием антиаритмиков можно прекратить, возобновляя его по мере необходимости, избегая длительного непрерывного использования препаратов. При потенциально злокачественных и злокачественных аритмиях применение прерывистой тактики лечения антиаритмиками, особенно амиодароном, мы также считаем возможным во многих случаях при достижении стойкой ремиссии, отсутствии рецидивов аритмий в течение нескольких недель, наряду с улучшением показателей гемодинамики, снижением частоты ангинозных атак и т.п. Этому в значительной мере может способствовать лечение основного заболевания, в частности, использование ингибиторов АПФ (эналаприл)
, дезагрегантов, статинов, оздоровление образа жизни и т.д.
В заключение необходимо отметить, что правильно подобранную, осторожную терапию антиаритмическими препаратами на сегодняшний день можно считать ведущим методом лечения больных с желудочковыми аритмиями.
Список литературы Вы можете найти на сайте https://www.rmj.ru
Амиодарон –
Амиокордин (торговое название)
(KRKA)
Эналаприл –
Рениприл (торговое название)
(ICN Pharmaceuticals)
Литература:
1. Lown B., Wolf M. Approaches to sudden death from coronary heart disease. Circulation, 1971,44, 130–142
2. Myerburg R.J., Huikuri H.V., Castellanos A. Origins, classification and significance of ventricular arrhythmias. In: Spooner P.M., Rosen M.R. ed. Foundations of Cardiac Arrythmias. New York, Basel, Marcel Dekker Inc., 2001. 547–569
3. Vismara L.A., Amsterdam B.A., Mason D.T. Relation of ventricular arrhythmias in the late hospital phase of acute myocardial infarction to sudden death after hospital discharge. Am. J. Med., 1975, 5, 6–12
4. Bigger J.T. Identification of patients at high risk for sudden cardiac death. Am. J. Cardiol., 1984, 54, 3D–8D
5. Goldstein S., Bayes–de–Luna A., Guindo–Soldevila J. Sudden cardiac death. Armonk, Futura, 1994, 13–26
6. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability. Standards of measurement physiological interpretation and clinical use. Eur. Heart J., 1996, 17, 354–379
7. La Rovere M.T., Bigger J.T., Marcus F.I., et al. Baroreflex sensitivity and heart–rate variability in prediction of total cardiac mortality after myocardial infarction. ATRAMI Investigators. Lancet, 1998, 351, 478–484
8. Zabel M., Klingenheben T., Franz M.R. et al. Assessment of QT dispersion for prediction of mortality of arrhythmic events after myocardial infarction: results of a prospective long–term follow–up study, Circulation, 1998, 97, 2543–2550
9. Иванов Г.Г., Охлопкова Т.Г., Попов В.В. и др. Поздние потенциалы желудочков у больных с разными формами ишемической болезни сердца: значение для отдаленного прогноза и оценки проводимой терапии. Кардиология, 1998, №11, 28–33
10. Дощицин В.Л. Внезапная аритмическая смерть и угрожающие аритмии. Российский кардиологический журнал, 1999, №1, 46–51
11. Harrison D.C. Antiarrhythmic drug classification: new science and practical applications. Am. J. Cardiol., 1985, 56, 185–187
12. Epstein A.E., Bigger J.T., Wyse D.S. et al. Events in the Cardiac Arrhythmia Suppression Trial (CAST): Mortality in the entire population enrolled. J. Am. Coll. Cardiol., 1991, 18, 14–19
13. Teo K.K., Yusuf S., Furberg C.D. Antiarrhythmic Drug Therapy in Acute Myocardial Infarction. JAMA, 1993, 270, 1589–1595
14. Goldstein S., Brooks M.M., Ledingham R. et al. Association between ease of suppression of ventricular arrhythmia and survival. Circulation, 1995, 91, 79–83
15. Певзнер А.В., Бакалов С.А., Малахов В.И. и др. Результаты применения аллапинина, этацизина и боннекора в лечении больных с пароксизмальными желудочковыми тахиаритмиями при использовании внутрисердечного электрофизиологического исследования в качестве метода контроля. Кардиология, 1996, №6, 52–57
16. Добротворская Т.Е., Королева О.Н., Гордина О.В. и др. Клинический опыт применения пропафенона (ритмонорма) при нарушениях ритма у больных ишемической болезнью сердца. Клиническая медицина, 1996, №3, 51–53
17. Krumholz H.M., Radford M.J., Wang Y. et al. National use and effectiveness of beta–blockers for the treatment of elderly patients after acute myocardial infarction. JAMA, 1998, 280, 623–629
18. Kennedy H.L., Brooks M.M., Barker A.H. et al for the CAST investigators. Beta–blocker therapy in the cardiac arrhythmia suppression trial. Am. J. Cardiol, 1994, 74, 674–680
19. The Cardiac Insufficiency Bisoprolol Study II (CIBIS – II): A Randomised trial. CIBIS–II Investigators and Committees. Lancet, 1999, 353, 9–13
20. Strasberg B., Kusniec J., Lewin R.F. et al. An unusual ventricular tachycardia responsive to verapamil. Am. Heart J., 1986, 111, 190–192
21. Mason J.W. for the Electrophysiologic Study vs Electrocardiographic Monitoring (ESVEM) investigators – A comparison of electrophysiologic testing with holter monitoring to predict antiarrhythmic drug efficacy for ventricular tachyarrhythmias. N. Engl. J. Med., 1993, 329, 445–451
22. Reiffel J.A., Hahn E., Hartz V. et al. Sotalol for ventricular tachyarrhythmias: beta–blocking and class III contributions and relative efficacy vs class I drugs after prior drug failure. Am. J. Cardiol., 1997, 79, 1008–1053
23. MacNeil D.J., Davies R.O., Deichman D. Clinical safety profile of sofalol in the treatment of arrhythmia. Am. J. Cardiol., 1993, 72, 44A–50A
24. Marcus F.I. Clinical pharmacology of amiodarone. Ann. NY Acad. Sci., 1984, 427, 112–125
25. Преображенский Д.В., Сидоренко Б.А., Лебедева О.В. и др. Амиодарон (Кордарон): место в современной антиаритмической терапии. Клиническая фармакология и терапия. 1999, 8 (4), 71–77
26. Roy D., Talajic M., Dorian P. et al. Amiodarone to prevent recurrence of atrial fibrillation. N. Engl. J. Med., 2000, 342, 913–920
27. Кушаковский М.С. – Аритмии сердца (2–е издание). Санкт–Петербург, «Фолиант», 1999, 99–104
28. Scheinman M., Levine J.H., Cannon D. et al. Dose–ranging study of intravenous amiodarone in patients with life–threatening ventricular tachyarrhythmias. Circulation, 1995, 92, 3264–3272
29. The CASCADE Investigators. Randomized antiarrhythmic drug therapy in survivors of cardiac arrest. Am. J. Cardiol., 1993, 72, 280–287
30. Burkart E., Pfisterer M., Kiowski W. et al. Effect of antiarrhythmic therapy on mortality in survivors of myocardial infarction with asymptomatic complex ventricular arrhythmia. Basel Antiarrhythmic Study on Infarct Survival (BASIS), J. Am. Coll. Cardiol., 1990, 16, 1711–1718
31. Cairns J.A., Connolly S.J., Roberts R. et al – Randomized trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarization: CAMIAT. Lancet, 1997, 349, 675–682
32. Julian D.G., Camm A.J., Frangin G. et al. Randomized trial of effect of amiodarone on mortality in patients with left–ventricular dysfunction after recent myocardial infarction: EMIAT. Lancet, 1997, 349, 667–674
33. Doval H., Nul D., Grancelli H. et al for de Estudio de la Sobrevida en la Insuficiencia Cardiaca en Argentina (GESICA) – Randomized trial of low–dose amiodarone in severe congestive heart failure. Lancet, 1994, 344, 493–498
34. Singh B., Fletcher R. et al – Amiodarone in patients with congestive heart failure and asymptotic ventricular arrhythmia. N. Engl. J. Med., 1995, 333, 77–82
35. Sim J., McDonald K., Laveri P. Quantitative overview of randomized trials of amiodarone to prevent sudden cardiac death. Circulation, 1997, 96, 2823–2829
36. Amiodarone Trials Meta–Analysis (ATMA) investigators effect of prophylactic amiodarone on mortality after myocardial infarction and congestive heart failure, meta–analysis of individual data from 6500 patients in randomized trials. Lancet, 1997, 350, 1417–1427
37. Elizari M.V., Martinez J.M., Belziti C. et al on behalf of the GEMICA Study Investigators. Morbidity and mortality following early administration of amiodarone in acute myocardial infarction. European Heart J., 2000, 21, 198–205
38. Siebels J., Kuck K. and The CASH Investigators. Implantable cardioverter defibrillator compared with antiarrhythmic drug therapy in cardiac arrest survivors (The Cardiac Arrest Study Humburg). Am. Heart J., 1994, 127, 1139–1144
39. Conolly S.J., Gent M., Roberts R.S. et al. Canadian Implantable Defibrillator Study (CIDS). Am. J. Cardiol., 1993, 72, 103F–108F
40. The Antiarrhythmics vs Implantable Defibrillators (AVID) investigators. A comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from near–fatal ventricular arrhythmia. N. Engl. J. Med., 1997, 337, 1576–1583
41. Moss A.J., Hall W.J., Cannom D.C. et al. Improved survival with an implanted defibrillator in patients with coronary disease of high risk for ventricular arrhythmia. Multicentral Autonomic Defibrillator Implantation Trial (MADIT) Investigators. N. Engl. J. Med., 1996, 335, 1933–1940
42. Голицын С.П. Грани пользы и риска при лечении желудочковых нарушений ритма сердца. Международный журнал медицинской практики, 2000, 10, 56–64