Акция
Процесс может быть нейрогуморальным (естественным), т. е. увеличение размеров матки происходит в результате усиленной работы желез внутренней секреции при беременности, в период лактации или во время менструации. Специалисты называют такое состояние рабочим, оно не требует никакой медицинской помощи и не доставляет женщине особых неудобств.
Патология — это когда гипертрофия матки спровоцирована какими-либо аномальными процессами в самом органе или травматическими повреждениями. Например, увеличиться в размерах матка может при миоме, эндометриозе, злокачественной опухоли, также это может быть последствием хирургических вмешательств, абортов, осложненных родов и т. д.
На заметку:
нередко причиной гипертрофии матки может стать избыточная секреция гормонов, которые стимулируют увеличение органа как целиком, так и в отдельных его участках.
Гипертрофия аденоидов
Гипертрофия аденоидов (аденоидные вегетации/разрастания, гипертрофия носоглоточной/глоточной миндалины) – это стойкое увеличение носоглоточной миндалины. Может встречаться как изолированно, так и в сочетании с гипертрофией небных миндалин.
Носоглоточная миндалина (аденоиды) – скопление лимфоэпителиальной ткани в верхней части носоглотки. Результат ее увеличения называется гипертрофией аденоидов, а при воспалении процесс называют аденоидитом. В сочетании с небными, трубными и язычной миндалинами составляют кольцо Пирогова-Вальдейера, расположенного на входе в верхние дыхательные пути и пищеварительный тракт и выполняющего роль местного иммунного барьера.
Гипертрофия аденоидов чаще всего наблюдается в возрасте от 2 до 6 лет, но может встречаться и в более позднем возрасте.
Существует несколько классификаций аденоидов по степени увеличения. Наиболее популярно разделение, основанное на субъективной оценке врачом размера миндалины при осмотре:
- I степень – просвет хоан перекрыт на 1/3
- II степень – просвет хоан перекрыт на 1/3–2/3
- III степень – хоаны закрыты аденоидами полностью.
Однако недостаточно только оценки размера миндалины, важным критерием является тщательный сбор анамнеза.
Причины
Гипертрофия аденоидов I-II степени в возрасте от 2 до 6 лет зачастую является физиологическим процессом, который связан с тем, что ребенок начинает активно контактировать с окружающим миром и миндалина подвергается постоянной антигенной стимуляции.
Выраженная (или патологическая) гипертрофия, которая приводит к описанным ниже симптомам, может возникнуть из-за инфекционной или неинфекционной причины. Среди инфекционных выделяют следующие:
- вирусные (аденовирус, вирус Коксаки, цитомегаловирус, вирус Эпштейна-Барр, вирус простого герпеса, вирус парагриппа, риновирус и др.)
- бактериальные (Streptococcus, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus, Neisseria, Mycoplasma pneumoniae, Fusobacterium, Peptostreptococcus, Prevotella и др.)
Среди неинфекционных причин выделяют гастроэзофагеальный рефлюкс, аллергию, длительное воздействие сигаретного дыма.
Симптомы
Симптоматика при гипертрофии возникает из-за увеличения размеров миндалины и/или наличия в ней хронических воспалительных изменений (хронический аденоидит). Хотя эти процессы зачастую связаны (длительное воспаление приводит к гипертрофии), нужно учитывать, что так происходит не всегда. Например, при аденоидных вегетациях I степени могут присутствовать выраженные признаки хронического воспаления, а при вегетациях III степени может вообще не быть клинических проявлений. При физиологической гипертрофии процесс проходит без каких-либо симптомов либо с незначительными проявлениями.
При выраженной гипертрофии у ребенка затруднено носовое дыхание, в связи с чем он дышит через рот, храпит во время сна, иногда с остановками дыхания (синдром обструктивногоапноэ во сне). Нарушение вентиляции полости носа приводит к слизистым выделениям, частым риносинуситам. Характерно чихание, неприятный запах изо рта. Крупные аденоиды давят на мягкое небо, у детей нарушается фонация и артикуляция, дети гнусавят. Если аденоиды блокируют слуховые трубы, это может проявляться рецидивирующими острыми отитами, снижением слуха, связанным со скоплением в среднем ухе жидкости (экссудативный средний отит). Со временем из-за кислородного голодания ребенок становится вялым и апатичным, раздражительным. Происходит ухудшение памяти, снижение внимания, трудности в обучении. Сон с открытым ртом в течение длительного времени приводит к нарушению развития лицевого скелета. Твердое небо становится высоким и узким, нижняя челюсть узкой и удлиненной, нарушается прикус, что в будущем может потребовать ортодонтического лечения. Опытный оториноларинголог сразу распознает типичный «аденоидный» вид ребенка.
Различают острое и хроническое воспаление слизистой оболочки носоглоточной миндалины:
- Острый аденоидит – острое воспаление, вызванное вирусной или бактериальной инфекцией. Проявляется как простуда: лихорадкой, затруднением носового дыхания, серозными или гнойными выделениями из носа. Длительность заболевания варьирует и не превышает одного месяца. При наличии гипертрофии аденоидов к перечисленным проявлениям добавляются явления, характерные для гипертрофии.
- Хронический аденоидит – хроническое полиэтиологическое заболевание, в основе которого лежит нарушение местных иммунных процессов, образование устойчивых микробных биопленок. Проявляется затруднением носового дыхания, серозными или гнойными выделениями из носа, стеканием слизи по глотке и кашлем. Причины у заболевания такие же, как и у гипертрофии. Нет единого мнения о длительности аденоидита, при котором его можно считать хроническими. По разным данным должно пройти не менее 12 недель от начала заболевания. Данное состояние может возникать самостоятельно и со временем приводить к гипертрофии аденоидов.
Диагностика
Золотым стандартом диагностики в общемировой практике и стандартом нашей больницы является проведение эндоскопического осмотра полости носа. Данное исследование мы проводим тонким гибким фиброскопом под местной анестезией.
Проведение рентгенографии в боковой проекции является распространенным способом оценки гипертрофии, однако может вводить в заблуждение. Например, на рентгенограмме может быть видна картина аденоидов III степени из-за увеличения трубных миндалин (они находятся по бокам от носоглоточной), из-за отека слизистой оболочки или скопления густой слизи. Данный метод применяется только в случае невозможности проведения эндоскопии носоглотки.
Важно проводить дифференциальную диагностику с заболеваниями, которые могут иметь похожие клинические проявления (юношеская ангиофиброма, атрезия хоан, полипоз, увеличение задних концов нижних носовых раковин, гипертрофия трубных миндалин).
Лечение
Физиологическая гипертрофия без каких-либо проявлений или с минимальной симптоматикой лечения не требует, однако необходим эндоскопический осмотр для проведения дифференциальной диагностики.
Лечение может быть консервативным. Оно включает устранение факторов, которые могут вызывать гипертрофию: аллергия, гастроэзофагеальный рефлюкс, пассивное курение. Соответственно, в ряде случаев необходим мультидисциплинарный подход оториноларинголога, аллерголога, гастроэнтеролога и педиатра. Положительный эффект может оказать смена климата на более благоприятный, например, морской. Топические кортикостероиды у детей с трех лет используются в качестве дополнительного лечения, при этом в ряде исследований отмечался некоторый положительный эффект, но целом данные об эффективности этих препаратов неоднозначны. При остром и обострении хронического аденоидита в случае бактериальной инфекции проводится лечение антибиотиками. Также в лечении используют орошение носоглотки солевым раствором. Применение различных масел, муколитиков, местных антибактериальных препаратов, растворов серебра, фитопрепаратов, физиотерапия на сегодняшний день не имеют качественной доказательной базы.
В некоторых случаях без оперативного лечения не обойтись. Операция нужна далеко не каждому ребенку и для нее нужны конкретные показания. При их определении врачи Ильинской Больницы следуют принципам доказательной медицины, опираясь на общемировой опыт. Среди показаний – неэффективность консервативного лечения, рецидивирующие инфекции, острые отиты и синуситы, «аденоидное» лицо. Родители должны понимать, что длительный отказ от операции при наличии показаний, попытка «переждать» или «перерасти» гипертрофию аденоидов может привести к осложнениям, лечение которых в дальнейшем потребует большого количества времени и может отрицательно повлиять на развитие ребенка. Согласно рекомендациям Американской Академии Оториноларингологии и Хирургии Головы и Шеи, аденотомию следует проводить в следующих случаях:
- У детей до 4 лет при наличии симптомов затруднения носового дыхания, признаков хронического аденоидита, а также экссудативногосреднего отита
- У детей 4 лет и старше при наличии экссудативного среднего отита
- При наличии подтвержденного обструктивного апноэ сна (периодическое резкое уменьшение или остановка дыхания во время сна)
При наличии патологии небных миндалин зачастую операцию по их резекции/удалению проводят одновременно (аденотонзиллотомия/аденотонзиллэктомия), а при экссудативном среднем отите одновременно проводят шунтирование.
Аденотомия со временем претерпела значительные изменения. Ранее эту операцию проводили под местной анестезией с помощью специального ножа (аденотом) под контролем небольшого зеркала, а иногда и вслепую. Во время операции ребенок испытывал стресс, а хирург мог не в полном объеме выполнить операцию. В наше время подобный подход практически не используется, однако в некоторых клиниках сохранился.
Симптомы
В зависимости от причины гипертрофии будет наблюдаться определенная клиническая картина, но общими признаками увеличенной в размерах матки являются:
- тянущие боли в области поясницы;
- ноющая боль в нижней части живота;
- обильные кровотечения во время месячных;
- межменструальные кровянистые выделения;
- частое вздутие живота, метеоризм, запоры;
- учащенное мочеиспускание, недержание мочи;
- увеличение массы тела без видимых причин;
- болезненность во время полового акта.
Подобные проявления могут наблюдаться не у всех женщин, поэтому часто увеличение матки диагностируется только на гинекологическом осмотре или при УЗИ органов малого таза по другому поводу.
Диагностика и лечение гипертрофии матки в СМЦ «Бест Клиник»
Стандартный осмотр гинекологом дает лишь предположение об изменении размеров матки. Более точную информацию врач получает по результатам УЗИ и гистероскопии. Определившись с причиной гипертрофии, доктор может оставить пациентку под наблюдением, если для лечения нет серьезных показаний, или назначить дополнительные методы исследования.
Консервативная терапия или хирургическое вмешательство — выбор зависит от причины, возраста женщины, ее индивидуальных особенностей, сопутствующих заболеваний, наличия детей или желания иметь их и множества других факторов.
В СМЦ «Бест Клиник» врачи очень внимательно подходят к каждому случаю в отдельности, потому что от правильности постановки диагноза и верно подобранного лечения зависит не только здоровье женщины, но и вся ее будущая жизнь. Применяя все свои знания и используя современные методики и технологии, гинекологи и акушеры «Бест Клиник» стараются сохранить единственно важную женскую функцию — способность зачать, выносить и родить здорового малыша.
Гинекологический прием в СМЦ «Бест Клиник» проводится только по предварительной записи в силу высокой загруженности врачей. Поэтому воспользуйтесь предоставленной на нашем сайте возможностью и заранее запишитесь на прием к ведущим специалистам клиники по телефонам, указанным на сайте, или через предоставленную форму для записи.
Молекулярные механизмы гипертрофии сердца: Часть 1. Физиологическая гипертрофия
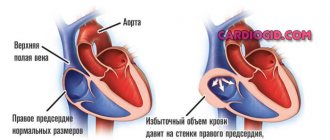
Гипертрофия сердца — компенсаторная реакция, возникающая в ответ на увеличение нагрузки на миокард. Физиологическая гипертрофия приводит к усилению функции миокарда: увеличению фракции выброса, усилению сократительной активности.
Выделяют два вида гипертрофии сердца: физиологическую и патологическую, которые отличаются молекулярными механизмами, кардиальным фенотипом и прогнозом для жизни. Последнее — наиболее важно в клинической практике, так как физиологическая гипертрофия помогает «протолкнуть» кровь при более высоких нагрузках, а патологическая ассоциирована с неблагоприятными состояниями, включая инфаркт миокарда, аритмии, и в перспективе может привести к летальному исходу. Также следует заметить, что эти варианты гипертрофии — «конкурентные антагонисты»; между различными сигнальными системами идет постоянная «борьба», результатом которой будет развитие либо физиологической, либо патологической гипертрофии. [1].
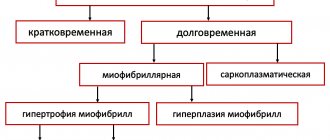
При физиологической гипертрофии наблюдается незначительное увеличение массы сердца (на 10–20 %), увеличение кардиомиоцитов (КМЦ) и их пролиферация, при этом фракция выброса сохранена или увеличена. В ткани нет склеротических и некротических изменений, и главное, — физиологическая гипертрофия полностью обратима (за исключением постнатальной) [1].
Механизмы физиологической гипертрофии
Начальные стимулы, приводящие к гипертрофии, не отличаются в случае физиологического или патологического вариантов (например, физическая нагрузка или артериальная гипертензия). Но запускающиеся при этом реакции кардинально различны. Для развития физиологической гипертрофии требуется следующее: увеличение размера клеток, усиление работы митохондрий и продукции энергии, ангиогенез, пропорциональный росту клеток, работа антиоксидантных систем, регуляция пролиферации и регенерации кардиомиоцитов [1].
Физиологическая гипертрофия сердца наблюдается от рождения ребенка и до его взросления (также называется постнатальной гипертрофией), при повышенных физических нагрузках, а также при беременности [2].
Механосенсоры
Механотрансдукция — фундаментальный процесс, сущностью которого является трансформация механических сигналов в биохимические. В сердце существуют сенсорные системы, которые воспринимают механические сигналы (изменения в давлении, объеме и т.д.) и активируют сигнальные системы, ответственные за физиологическую гипертрофию [2].
Ионные каналы с транзиторным рецепторным потенциалом (TRP — transient receptor potential channels) являются одной из таких систем. TRP — это целое суперсемейство трансмембранных белков, которое функционирует как неселективные ионные каналы. Среди них выделяют 7 субсемейств; эти рецепторы отличаются по локализации и своей роли в различных клеточных процессах [3].
Помимо TRP, механочувствительностью обладают различные интегрины. Это трансмембранные белки, способные взаимодействовать с внеклеточным матриксом (и разнообразными его компонентами: фибронектином, ламинином, коллагеном). Реагируя на внеклеточный агент, интегрины могут передавать информацию внутрь клетки путем особых интегрин-ассоциированных белковых комплексов. Это может быть киназа фокальной адгезии (FAK — focal adhesion kinase), интегрин-связанная киназа (ILK — integrin-linked kinase). Последние, в свою очередь, активируют разнообразные сигнальные пути — стандартную протеинкиназу С или PI3K/Act (см. ниже) [2].
Несколько подробнее следует остановиться на интегрин-ассоциированном белке, специфичном для мышечной ткани — мелузине. Он взаимодействует с β1-интегринами, способствуя развитию концентрической гипертрофии с сохранением сократительной активности сердца. Повышение синтеза мелузина инициирует физиологическую гипертрофию и предотвращает ее развитие по патологическому руслу. Верно и обратное: недостаток мелузина приводит к развитию дилатационной кардиомиопатии [1].
И, разумеется, нельзя не сказать о роли Z-линии как механорецептора. Эта часть кардиомиоцита также реагирует на растяжение, передавая сигнал множеству различных белков: телетонину, миопалладину, анкиринам, обскурину… В конечном итоге, все эти процессы оказываются крайне необходимыми для развития физиологической гипертрофии, тогда как дефекты некоторых из этих белков ведут к кардиомиопатиям [2].
Инсулин и инсулиноподобный фактор роста 1
Данные вещества регулируют множество разнообразных клеточных процессов в сердце: пролиферацию, дифференцировку, рост клетки, метаболизм, сократимость и апоптоз. При сердечной недостаточности часто наблюдается резистентность к инсулину. IGF1 (insulin-like growth factor 1) структурно идентичен инсулину; данный агент синтезируется в печени в ответ на СТГ, но также может образовываться и в других органах (в т.ч., в сердце) [1].
Инсулин, как известно, связывается с инсулиновым рецептором — тирозиновой киназой — который фосфорилирует субстраты инсулиновых рецепторов 1 и 2 (IRS1, 2-insulin receptor substrate). IRS в свою очередь активируют сигнальный путь PI3K/Act. Данный сигнальный путь может быть знаком читателю как потенциальная мишень противоопухолевой терапии. PI3K/Act участвует в регуляции клеточного цикла, а в нашем случае обеспечивает рост кардиомиоцитов в ответ на повышение нагрузки на миокард [2], [5].
IGF1 в свою очередь связывается со специфическим рецептором IGF1R (IGF1 receptor) с последующей активацией целого ряда сигнальных путей: RAS–RAF–MEK–MAPK, PLC–IP3R3 и других. Результатом этого также является физиологическая гипертрофия кардиомиоцитов.
Несколько подробнее следует остановиться на PI3K/Act пути (примечательно, что данный сигнальный путь активируется при физической нагрузке). PI3K — фермент-киназа, катализирующий фосфоинозитол-3,4,5-трифосфат. Активация одной из его каталитических субъединиц — p110α — инициирует процессы физиологической гипертрофии и препятствует патологической (как мы помним, данные процессы конкурируют между собой). ACT1 — еще одна киназа, которая активируется фосфоинозитол-3,4,5-фосфатом, и результатом ее работы становится изменение метаболизма клетки. Это достигается путем ингибирования ряда ферментов: гликоген синтазы киназы 3β (данная киназа ингибирует инициирующие трансляцию факторы), fox-O3 (фактор, ингибирующий общий метаболизм белков в клетке) и других. В результате идет активный синтез белка, клетка увеличивается в размере [1].
Трийодтиронин
Т3 — трийодтиронин, гормон щитовидной железы, который влияет как на постнатальную гипертрофию сердца, так и гипертрофию, вызванную физическими нагрузками (хотя последнее — не так достоверно) [2].
Сразу после рождения концентрация Т3 в крови существенно увеличивается. Гормон связывается с рецепторами TRα и TRβ (thyroid hormone receptors), что приводит к «переключению» транскрипции гена MYH7 на MYH6 (данные гены кодируют последовательности тяжелых цепей миозина — myosin heavy chains). MYH7 кодирует β-тяжелые цепи миозина, MYH6 — α-изоформу [1]. Это крайне важно, так как α-изоформа обладает большей АТФазной активностью и, как следствие, клетка с активным MYH6 способна сокращаться сильнее [2], [6].
Взаимодействие Т3 с рецепторами к ретиноевой кислоте (ядерные рецепторы стероидных и тиреоидных гормонов, прим.) приводит к увеличению экспрессии кальциевой АТФазы-2 (SERCA2 — sarcoplasmatic/endoplasmatic reticular calcium ATPase-2), ингибируя MYH7 и экспрессию фосфоламбана (белок в кардиомиоцитах, который супрессирует SERCA2) [2].
SERCA2 — эволюционно наиболее древняя изоформа кальциевых АТФаз млекопитающих. Всего таких изоформ три (с подтипами). SERCA2 имеет три подтипа: a, b и с; для сердца наиболее специфична SERCA2а (97,5 %), также имеется небольшое количество SERCA2b (2,5 %). Функция данного белка состоит в контроле цитозольного Ca2+ и, как следствие, в регуляции сократительной функции всего кардиомиоцита [7].
Фосфоламбан, работу которого ингибирует Т3, является белком-регулятором SERCA2 (точнее, наиболее изученным из этих регуляторов). В своем активном — дефосфорилированном — состоянии фоcфоламбан супрессирует SERCA2 и приводит к снижению концентрации Ca2+ в цитоплазме, что, в свою очередь, снижает сократительную способность кардиомиоцита [2], [7].
Помимо этого, Т3 также активирует транскрипцию β1-адренорецепторов, белков натриевых и кальциевых каналов, сердечного тропонина I, белков натрий/кальциевой помпы и аденилатциклазы V и VI типов [1], [2]. Также гормон увеличивает содержание TRα1, который активирует уже известный нам PI3K [2].
Конечным результатом работы трийодтиронина в кардиомиоцитах является усиление сократительной активности миокарда и кардиопротекция [1].
Оксид азота (NO)
Физическая нагрузка стимулирует β3-адренорецепторы в эндотелиоцитах, в ответ активируется эндотелиальная NO-синтаза (NOS3), которая синтезирует собственно оксид азота — известное вазоактивное вещество. После этого происходит следующее:
NО активирует растворимую гуанилатциклазу → повышается содержание цГМФ → активируется цГМФ-зависимая протеинкиназа G (PKG) → PKG фосфорилирует два белка-регулятора (RGS2 и RGS4), которые ингибируют G-связанные рецепторы, ответственные за развитие патологической гипертрофии.
Такая схема нужна для того, чтобы гипертрофия развивалась по физиологическому варианту. Дефект либо β3-адренорецепторов, либо NOS3, либо белков RGS2 и RGS4 ведет к разрыву всей цепи кардиопротекции, что вполне может закончиться инфарктом миокарда [1].
Ангиогенез
Для нормального функционирования клеткам нужно достаточное кровоснабжение. Если плотность сосудов увеличивается соразмерно росту кардиомиоцитов — развивается физиологическая гипертрофия. Но когда клетки растут быстрее, чем того может позволить капиллярная сеть — возникает хроническая гипоксия.
Одним из важнейших факторов, определяющих ангиогенез, является сосудистый эндотелиальный фактор роста (VEGF — vascular endothelial growth factor). VEGF также может быть знаком читателю — ингибиторы данного фактора используются при лечении различных видов рака. Однако подобные препараты обладают существенной кардиотоксичностью и могут привести к различным кардиомиопатиям (что косвенно свидетельствует о важности VEGF для функционирования миокарда). Помимо прочего, изменение уровня VEGF также связано с перипартальной (послеродовой) кардиомиопатией [1], [2].
В начале статьи упоминались сигнальные молекулы NFAT (в разделе «механосенсоры»). VEGF, влияя на эндотелиоциты, действуют именно через систему NFAT, вызывая усиленный ангиогенез. Таким образом, данные нуклеарные факторы, помимо своей антиапоптотической роли, влияют и на кровоснабжение кардиомиоцитов [8].
Помимо VEGF, важную роль оказывает и тромбоцитарный фактор роста (PDGD — platelet-derived growth factor). Доподлинно неизвестны механизмы, которыми осуществляется влияние PDGD на ангиогенез; однако дефект данного фактора в экспериментах на мышах приводит к сердечной недостаточности и ухудшению кровоснабжения [1].
Также нельзя не упомянуть о еще одном важнейшем веществе. Гипоксия-индуцируемый фактор 1α (HIF1α — hypoxia-inducible factor) — это главный фактор транскрипции, обеспечивающий постоянное снабжение клеток кислородом путем регуляции ангиогенеза, модификации сосудов и регуляции метаболизма глюкозы. В случае патологической гипертрофии антиген р53 (известный своей связью с развитием опухолей) активирует убиквитинирование и протеасомную деградацию HIF1α [1]. В норме же HIF1α активирует различные сигнальные молекул (в т.ч. VEGF) и способствует усиленному ангиогенезу.
Нейрегулин-1
Нейрегулины (1-4) — это члены семейства эпидермальных факторов роста. В сердечно-сосудистой системе представлен в основном нейрегулин-1. Сигнальный путь этого фактора (и его рецепторов) играет важную роль в адаптации миокарда к нагрузке и формировании сердечной мышцы.
Нейрегулин-1 действует на киназу семейства ErbB (группа молекул, структурно схожих с эпидермальным фактором роста; белки данного семейства часто рассматриваются как потенциальные онкомаркеры, прим.). Нейрегулин-1 активирует ErbB2 и ErbB4, что приводит к стимуляции уже упоминавшейся PI3K-системы. Результатом этого взаимодействия является пролиферация кардиомиоцитов, что предотвращает ишемические поражения [1].
МикроРНК и РНК-связывающие белки
МикроРНК (мкРНК) экспрессируются в сердце при физиологической гипертрофии, индуцированной аэробной физической нагрузкой. Например, мкРНК-222 у мышей ингибирует четыре мишени, потенциально ответственные за декомпенсацию и развитие сердечной недостаточности: р-27 (кодирует ингибитор клеточного цикла), Hipk1 и Hipk2 (кодируют протеиновые киназы), Hmbox1 (кодирует ингибитор транскрипции). Иными словами, активация мкРНК-222 способствует росту и пролиферации кардиомиоцитов [1].
Также любая форма гипертрофии нуждается в синтезе белка de novo. И здесь задействованы эукариотический фактор трансляции 4F (elF4F) и мишень рапамицина млекопитающих mTORC1 — вместе они запускают усиленный синтез белка. Помимо этого, в ответ на физиологический (и патологический) стимул в клетках миокарда происходит элонгация поли-А последовательности и экспрессия специфического полиаденилат-связывающего белка 1 (PABPC1 — polyadenylate-binding protein 1), который связывается с elF4F и таким образом способствует накоплению в клетках различных строительных (и не только) белков. Повышенная экспрессия PABPC1 в кардиомиоцитах необходима для физиологической гипертрофии (о роли белка в патологическом ее варианте пока что ничего не известно) [1].
Источники:
- M. Nakamura and J. Sadoshima, ‘Mechanisms of physiological and pathological cardiac hypertrophy’, Nat. Rev. Cardiol., vol. 15, no. 7, pp. 387–407, 2021.
- M. Maillet, J. H. Van Berlo, and J. D. Molkentin, ‘Molecular basis of physiological heart growth: Fundamental concepts and new players’, Nat. Rev. Mol. Cell Biol., vol. 14, no. 1, pp. 38–48, 2013.
- B. Nilius and G. Owsianik, ‘The transient receptor potential family of ion channels’, Genome Biol., vol. 12, no. 3, 2011.
- W. T. Pu, Q. Ma, and S. Izumo, ‘NFAT transcription factors are critical survival factors that inhibit cardiomyocyte apoptosis during phenylephrine stimulation in vitro’, Circ. Res., vol. 92, no. 7, pp. 725–731, 2003.
- M. Osaki, M. Oshimura, and H. Ito, ‘PI3K-Akt pathway: Its functions and alterations in human cancer’, Apoptosis, vol. 9, no. 6, pp. 667–676, 2004.
- E. M. McNally, R. Kraft, M. Bravo-Zehnder, D. A. Taylor, and L. A. Leinwand, ‘Full-length rat alpha and beta cardiac myosin heavy chain sequences’, J. Mol. Biol., vol. 210, no. 3, pp. 665–671, 1989.
- P. Vangheluwe, L. Raeymaekers, L. Dode, and F. Wuytack, ‘Modulating sarco(endo)plasmic reticulum Ca2+ ATPase 2 (SERCA2) activity: Cell biological implications’, Cell Calcium, vol. 38, no. 3-4 SPEC. ISS., pp. 291–302, 2005.
- T. A. Zaichuk, E. H. Shroff, R. Emmanuel, S. Filleur, T. Nelius, and O. V. Volpert, ‘Nuclear factor of activated T cells balances angiogenesis activation and inhibition’, J. Exp. Med., vol. 199, no. 11, pp. 1513–1522, 2004.