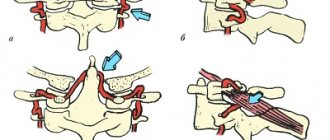
Чкв (чрескожное коронарное вмешательство) используют в кардиологии для возобновления движения крови по артерии сердца. Оно может предупредить инфаркт миокарда или уменьшить его распространение. Назначается в экстренном или плановом порядке. Абсолютные противопоказания – кровотечение и невозможность завести катетер по сосудистой сети.
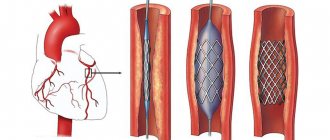
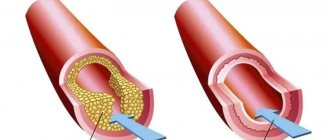
Операция проходит в виде баллонного расширения места сужения и удаления бляшки, установки каркаса из металла (стентирование) или применяется лазерная реваскуляризация. Метод ЧКВ малотравматичный, так как нужен только прокол бедренной артерии, он уменьшает частоту приступов стенокардии и повышает переносимость нагрузок.
Минусом является риск повторной закупорки, поэтому важно пожизненно принимать препараты для уменьшения вязкости крови, придерживаться диеты, дозированной физической активности, отказаться от курения и злоупотребления алкоголем.
ЧКВ в кардиологии — что это такое
Расшифровка ЧКВ – чрескожное коронарное вмешательство, оно применяется в кардиологии для восстановления проходимости артерии сердца. Рекомендуется при атеросклерозе сердечных сосудов – стенокардии, инфаркте миокарда. Чрескожным называется потому, что в сосуд проникает катетер, введенный через кожу. Для этого обычно используется бедренная артерия, а ход инструментария отслеживается при помощи рентгенографии.
Существует 3 способа ЧКВ – баллонная ангиопластика, стентирование и лазерная реваскуляризация. В первом случае просвет расширяется при помощи раздувающегося баллона, он раздавливает бляшку, во втором дополнительно в эту зону ставят стент (каркас из металла), а в третьем лучи лазера разрушают скопления холестерина.
Рекомендуем прочитать статью о ЧПЭФИ сердца. Из нее вы узнаете о преимуществах и недостатках метода, показаниях к ЧПЭФИ сердца, а также о том, как проводится чреспищеводное электрофизиологическое исследование. А здесь подробнее о разрыве миокарда.
Показания к ЧКВ
К показаниям для проведения операции ЧКВ относятся:
- инфаркт миокарда;
- стенокардия с нестабильным течением или предынфарктным состояниям (приступы становятся чаще и сильнее, есть нарушения ритма, типичные изменения ЭКГ, ферментов крови, сердечная недостаточность);
- стабильная стенокардия при устойчивости к медикаментам или противопоказаниях для их постоянного применения;
- нестабильная атеросклеротическая бляшка (опасная в отношении инфаркта), обнаруженная при обследовании;
- сужение просвета сосуда после операции аортокоронарного шунтирования или уже проведенном ранее стентировании.
Противопоказания к проведению
Невозможно провести ЧКВ только при обширном кровотечении (нельзя принимать потом противосвертывающие препараты) и распространенном поражении сосудистой сети, когда катетер сложно завести в место сужения. Все остальные противопоказания к ангиопластике врач оценивает только в индивидуальном порядке, сопоставляя риск от операции и ее отсутствия:
- просвет артерии до 3 мм, а участок сужения более 20 мм;
- множественные изменения коронарных сосудов;
- низкая свертывающая активность крови, анемия;
- поражение сосудов в конечностях (особенно бедренной), через которые будет вводиться катетер;
- невозможность провести коронарографию из-за непереносимости контрастных веществ;
- артериальная гипертензия, которую не удается контролировать медикаментами;
- высокая температура тела, инфекция, обострение воспаления;
- декомпенсированный сахарный диабет;
- противопоказания для применения препаратов для разжижения крови после операции (помимо кровотечения);
- недостаточность функции почек, печени;
- нарушение кровообращения в мозговых артериях;
- болезни психики;
- новообразования;
- поражение клапанов сердца;
- бактериальный эндокардит;
- ревматизм, миокардит.
Выполнение первичного чрескожного коронарного вмешательства (ЧКВ) — основной современный метод лечения пациентов с инфарктом миокарда (ИМ) с подъемом сегмента ST (пST) [10]. Основной проблемой после выполнения ЧКВ у таких пациентов являются выраженная обструкция микрососудов или феномен no-reflow [5]. Результаты ряда исследований продемонстрировали, что у пациентов с феноменом no-reflow чаще встречаются ранние осложнения ИМ (аритмии, выпот в полость перикарда, тампонада сердца, ранняя застойная сердечная недостаточность); неблагоприятное ремоделирование левого желудочка; повторные госпитализации по поводу сердечной недостаточности и увеличивается летальность [1, 2, 6, 7, 12]. Следовательно, выявление, профилактика и лечение феномена no-reflow имеют наиважнейшее значение для результатов первичного ЧКВ.
Возникновение феномена no-reflow служит причиной меняющейся комбинации четырех патогенетических компонентов: 1) дистальной атеротромботической эмболии; 2) ишемического повреждения; 3) реперфузионного повреждения; 4) чувствительности микроциркуляции миокарда к повреждению [14].
Логическими предпосылками в профилактике дистальной эмболии при проведении ЧКВ является использование устройств для аспирации тромба, так как с их помощью можно уменьшить объем тромба в просвете артерии, лучше визуализировать истинное поражение и выполнить прямое стентирование без предварительной баллонной ангиопластики. В настоящее время представлены несколько моделей для тромбэктомии, которые можно разделить на катетеры для ручной аспирации тромбов и устройства для реолитического разрушения и аспирации тромбов за счет эффекта Вентури [13, 16].
Стратегии, направленные на сокращение времени от начала болевого синдрома за грудиной до выполнения баллонной анигиопластики, широко изучены и могут уменьшить частоту возникновения no-reflow посредством сокращения общего времени ишемии. Кроме того, известные лекарственные препараты, уменьшающие потребность миокарда в кислороде и, следовательно, значимость ишемии, могут улучшать результаты, по крайней мере частично, посредством улучшения перфузии миокарда [14].
Результаты ряда исследований, в которые были включены пациенты с высоким риском возникновения феномена no-reflow, имеющих факторы риска повреждения, связанного с реперфузией, продемонстрировали противоречивые результаты по эффективности использования блокаторов IIb/IIIa гликопротеиновых рецепторов тромбоцитов. Необходимо отметить, что по данным других исследований, использование блокаторов IIb/IIIa гликопротеиновых рецепторов связано с увеличением числа кровотечений при проведении ЧКВ [10].
Несмотря на то что генетически определенную чувствительность к микроциркуляторному повреждению сложно корректировать, приобретенная чувствительность может поддаваться лечению. Действительно, оптимальное и быстрое лечение гипергликемии — вероятно, наиболее важная цель в профилактике no-reflow. Согласно результатам исследования DIGAMI, снижение уровня глюкозы в крови связано с сокращением размеров инфаркта. Более того, статины также потенциально способны сократить размеры реперфузионного повреждения [11]. К. Iwakura и соавт. [9] продемонстрировали, что постоянная терапия статинами у пациентов с гиперхолестеринемией или без нее связана с более низкой частотой no-reflow и лучшим функциональным восстановлением.
Цель исследования — определение эффективности и безопасности использования устройств аспирации тромба в комбинации с внутривенным введением эптифибатида в профилактике выраженной обструкции микрососудов (феномена no-reflow) при выполнении первичного ЧКВ у пациентов с ИМпST.
Материал и методы
С октября 2009 г. по февраль 2011 г. на базе отделения рентгенохирургических методов диагностики и лечения ГКБ №12 проводилось лечение 92 пациентов с острым ИМ. Критериями включения в исследование являлись давность ИМпST не более 12 ч, ангиографические признаки тромба в просвете эпикардиальной коронарной артерии. Критерии исключения: наличие ИМ в анамнезе, кардиогенный шок, перенесенное коронарное шунтирование, блокада левой или правой ножек пучка Гиса, ритм электрокардиостимулятора.
Все пациенты были разделены на две группы: 1-ю группу составили 45, 2-ю группу — 47. Пациенты 1-й и 2-й групп были сопоставимы по исходным клиническим характеристикам (табл. 1).
Перед выполнением вмешательства все пациенты получали 600 мг клопидогрела и 300 мг ацетилсалициловой кислоты перорально. После этого пациентам выполняли коронарографию, по результатам которой в сопоставлении с данными ЭКГ определяли локализацию поражения в инфаркт-ответственной артерии (табл. 2).
У всех пациентов в 1-й и во 2-й группах наблюдения определялись ангиографические признаки тромба в просвете инфаркт-ответственной артерии.
Во время проведения ЧКВ всем пациентам 1-й и 2-й групп внутривенно вводили 70 ед/кг нефракционированного гепарина. Первым этапом ЧКВ выполняли механическую реканализацию проводником. Затем в 1-й группе пациентов осуществляли аспирацию тромба с помощью катетера Export («Medtronic», США) и вводили блокатор IIb/IIIa гликопротеиновых рецепторов тромбоцитов эптифибатид, внутривенно струйно 180 мкг/кг с последующей постоянной инфузией 2,0 мкг/кг/мин в течение ЧКВ и 12 ч после выполнения операции. Во 2-й группе выполняли баллонную ангиопластику. ЧКВ как в 1-й, так и во 2-й группах завершали выполнением стентирования.
Адекватность реперфузии после выполнения вмешательства оценивали по степени кровотока по шкале TIMI и миокардиального контрастирования по результатам коронарографии и снижению сегмента ST по результатам электрокардиографии. Адекватной считали реперфузию при степени кровотока TIMI 3 в сочетании со степенью миокардиального контрастирования 2 или 3 и снижение подъема сегмента ST более чем на 70% через 1 ч после завершения вмешательства. Неадекватную реперфузию (феномен no-reflow) констатировали при кровотоке по шкале TIMI <3 или 3 со степенью миокардиального контрастирования от 0 до 1 и снижении подъема сегмента ST на 70% и менее через 1 ч после завершения вмешательства.
На госпитальном этапе наблюдения оценивали следующие показатели: повторный ИМ, повторное ЧКВ, клинически значимые кровотечения и смерть. К клинически значимым кровотечениям относили внутричерепные кровотечения; кровотечения, вызывающие нестабильность гемодинамики или требующие вмешательства; кровотечения, требующие переливания крови, но не приводящие к нарушению гемодинамики.
В отдаленном периоде наблюдения (через 12 мес) оценивали следующие показатели: повторные ИМ, возврат клинических проявлений стенокардии, функциональный класс (ФК) сердечной недостаточности (СН) по классификации Нью-Йоркской Ассоциации кардиологов (NYHA) и смертность.
Статистический анализ выполняли с использованием программы Statistica 7.0 («StatSoft Inc.», США). Сравнение количественных переменных производили с использованием критерия Манна—Уитни, качественных переменных — с использованием двустороннего критерия Фишера и критерия χ2 Пирсона. Различия считали статистически значимыми при p<0,05.
Результаты
При выполнении ЧКВ в 1-й группе с использованием устройства для аспирации тромба у 34 (75,6%) пациентов были получены макроскопические фрагменты тромба. Ангиографические критерии эпикардиального кровотока и тканевой перфузии после выполнения стентирования в 1-й и во 2-й группах представлены в табл. 3.
По ангиографическим критериям адекватная реперфузия определялась статистически значимо чаще в 1-й группе пациентов.
Через 1 ч после завершения вмешательства в отделении реанимации снимали ЭКГ и оценивали динамику сегмента ST (табл. 4).
Были выявлены статистически значимые различия по снижению сегмента ST через 1 ч после ЧКВ в пользу группы, где выполнялась тромбоэкстракция с одновременным введением эптифибатида.
В течение 30 дней оценивали кардиальные осложнения и кровотечения (табл. 5).
Статистически значимо чаще летальные исходы были зарегистрированы в группе, где выполнялось стандартное ЧКВ. При анализе летальных исходов у пациентов 2-й группы установлено, что в данных наблюдениях после ЧКВ не были достигнуты критерии адекватной реперфузии.
Через 12 мес были изучены отдаленные результаты у 40 пациентов 1-й группы и у 38 2-й группы (табл. 6).
Статистически значимых различий между 1-й и 2-й группами пациентов по показателям частоты повторного ИМ, возврата стенокардии и смертности не выявлено.
У пациентов без повторных ИМ и возврата стенокардии через 12 мес наблюдения определяли ФК СН по классификации NYHA (табл. 7).
Статистически значимо чаще во 2-й группе пациентов определялся III ФК СН по NYHA через 12 мес наблюдения. При анализе пациентов 2-й группы с СН III ФК было установлено, что после выполнения ЧКВ у них не были достигнуты критерии адекватной реперфузии.
Обсуждение
В настоящее время в Европе и США проведен ряд исследований у пациентов с ИМпST, в которых использовались различные системы для аспирации тромба и защиты микроциркуляторного русла.
В проспективное рандомизированное исследование TAPAS был включен 1071 пациент с ИМпST. Результаты исследования продемонстрировали, что у пациентов с ИМпST стратегия аспирации коронарного тромба перед первичным ЧКВ со стентированием не только приводит к улучшению перфузии миокарда сразу после операции, но и сопровождается лучшими отдаленными клиническими результатами по сравнению со стандартным вмешательством [16]. Результаты исследований DEAR-MI и REMEDIA также продемонстрировали лучшую реперфузию миокарда непосредственно после вмешательства при использовании катетеров для аспирации тромбов [4, 15]. Показательными являются результаты метаанализа 11 исследований, в которые были включены 2686 пациентов. На основании полученных данных был сделан вывод, что использование устройств для аспирации тромба значительно улучшает клинические результаты у пациентов с ИМпST, подвергающихся механической реперфузии [3].
В нашем исследовании в группе пациентов, у которых использовались устройства для аспирации тромба в комбинации с внутривенным введением эптифибатида, результаты по восстановлению эпикардиального кровотока и перфузии миокарда после выполнения ЧКВ были статистически значимо лучше, чем в контрольной группе.
В этой группе пациентов также чаще определялось снижение сегмента ST более 70% через 1 ч после выполнения ЧКВ. В госпитальном периоде наблюдения были получены статистически значимые различия по летальности в пользу группы, где использовались устройства для аспирации тромба в комбинации с внутривенным введением эптифибатида. Необходимо отметить, что использование эптифибатида в 1-й группе пациентов не увеличивало количество кровотечений. В течение 12 мес наблюдения группы пациентов не различались по частоте развития повторного ИМ, повторного выполнения ЧКВ и смертности. Однако статистически значимо реже в группе пациентов, где использовалась профилактика обструкции микрососудов, определялся III ФК СН по NYHA в отдаленном периоде наблюдения.
Выводы
1. При выполнении первичного ЧКВ с использованием устройств для аспирации тромба в комбинации с внутривенным введением эптифибатида выраженная обструкция микрососудов (феномен no-reflow), оцениваемая по ангиографическим и ЭКГ-критериям, определяется статистически значимо реже.
2. При выполнении первичного ЧКВ с использованием устройств для аспирации тромба в комбинации с внутривенным введением эптифибатида статистически значимо снижаются летальность в госпитальный период наблюдения и число пациентов с III ФК СН по классификации NYHA в отдаленном периоде наблюдения.
3. Использование эптифибатида в комбинации с двухкомпонентной антиагрегантной терапией и гепаринотерапией при выполнении первичного ЧКВ не связано с увеличением количества клинически значимых кровотечений.
Методики выполнения ЧКВ
ЧКВ проводится несколькими способами, при этом многие подходы одинаковые:
- подготовка – коронарография, анализы крови: общий, биохимия с почечными и печеночными тестами, сахар, холестерин, свертывание, на инфекции (вирусный гепатит, ВИЧ, сифилис), ЭКГ, УЗИ сердца и сосудов конечностей;
- местное обезболивание в области проекции бедренной артерии, разрез 2-3 мм;
- введение проводника и контрастного вещества;
- определение участка сужения;
- приближение катетера к месту расположения бляшки.
В дальнейшем, в зависимости от способа восстановления кровотока, расширяется баллончик и раздавливается холестериновая бляшка, устанавливается стент или разрушается атероматозные отложения лучами лазера.
После того, как восстановлен коронарный кровоток, инструментарий извлекают и накладывают давящую повязку на бедро.
Как проводят ЧКВ со стентированием
Если ЧКВ проходит со стентированием, то после раздувания баллоном в просвет сосуда устанавливают металлическую конструкцию – стент. Он вначале проходит в свернутом виде, а потом расправляется в месте сужения. Его установка не дает спадаться стенкам артерий, а также медикаментозное покрытие предупреждает повторную закупорку.
ЧКВ со стентом может быть методом лечения инфаркта миокарда, тогда его проводят в экстренном порядке в первые 6 часов, реже на протяжении 12. Если целью является предупреждение сосудистой катастрофы, то операция будет плановой, после углубленного обследования, что помогает избежать многих осложнений.
Коронарография сосудов сердца
Стентирование занимает около 2 часов. На протяжении ЧКВ бывают боль или неприятные ощущения в сердце, жжение за грудиной. По окончании всех манипуляций больной поступает в послеоперационную палату для постоянного наблюдения – контроля ЭКГ, артериального давления, пульса, ему проводят анализы крови и мочи для исключения нарушений коронарного кровообращения.
Через сутки при плановой и через 2-3 дня при экстренной операции можно находиться в обычной палате, при отсутствии осложнений выписывают пациента для реабилитации по месту жительства.
Стентирование
Стентирование — один из наиболее эффективных методов избавления больного от риска возникновения инфаркта, инсульта, а также постоянных приступов стенокардии. Оно помогает снабдить миокард необходимым количеством кислорода за счет установки сосудистого имплантата – стента.
Восстановление проходимости кровотока происходит под рентгенологическим контролем на протяжении всей операции. Хирурги, постоянно контролируя сердечный ритм оперируемого, вводят через катетер в тазобедренную артерию контрастное вещество.
Оно при смешивании с кровью заполняет сосуды, помогая врачам визуализировать область проведения работ. Наркоз при стентировании не требуется. Ввиду простоты и кратковременности операции достаточным является местное обезболивание, позволяющее врачам поддерживать контакт с оперируемым в процессе установки коронарных стентов.
С другой стороны, через плечевую артерию, вводится другой катетер со специальными «баллончиком», расширяющим внедренный ранее имплантат до размеров сосуда. В зависимости от состояния сосудистой системы и закупорки конкретной артерии, может устанавливаться не один, а 2 или даже 3 стента.
На заключительном этапе хирурги проверяют результат своей работы, оценивая, насколько беспрепятственно теперь проходит кровь по травмированному раннее коронарному сосуду.
Преимущества первичного чрескожного коронарного вмешательства в отличие от обычной операции
К преимуществам чрескожного коронарного вмешательства (по сравнению с шунтированием) относятся:
- не нужен общий наркоз, вентиляция легких, переход на искусственное кровообращение, вскрытие грудины;
- не требуется длительного восстановления;
- эффективность в отношении нормализации кровотока сопоставима – прекращаются боли в сердце или появляются реже;
- ниже риск нарушений кровотока мозга, послеоперационной пневмонии.
Но при ЧКВ чаще бывает закупорка стента или повторное сужение места расширения, что требует еще одной операции. Это осложнение встречается у каждого пятого пациента через 6-9 месяцев.
Мнение эксперта
Алена Арико
Эксперт в области кардиологии
К недостаткам любого метода оперативного улучшения коронарного кровообращения относится симптоматический эффект. Это означает, что таким образом можно убрать препятствие для движения крови, облегчить боли в сердце, но нельзя вылечить атеросклероз. Поэтому пациентам требуется длительная медикаментозная профилактика повторной закупорки артерий, препараты, снижающие вязкость крови, изменения образа жизни.
Противопоказания
ЧКВ в кардиологии – это неопасное хирургическое вмешательство, требующее тем не менее внимательного исследования общего состояния здоровья больного. Среди основных противопоказаний к чрескожному коронарному вмешательству кардиологи отмечают:
- устойчивость организма к антитромбоцитарной терапии;
- почечная недостаточность (ее острая или хроническая форма);
- дисфункции желудочно-кишечного тракта, в том числе продолжительные кровотечения;
- лихорадочные состояния (особенно при невозможности определения причин, спровоцировавших их возникновение);
- недавно перенесенный инсульт;
- анемия (средней и высокой степени);
- гипертензия (не поддающаяся контролю и медикаментозному воздействию);
- электролитные нарушения (при чем не только ярко выраженные, но и в скрытой форме);
- невозможность поддерживать контакт с оперируемым, например, по причине его нахождения в бессознательном или неадекватном состоянии;
- наличие тяжелого заболевания, на которое может оказать негативное влияние ЧКВ;
- отказ больного от послеоперационного медицинского сопровождения (при таких обстоятельствах невозможно контролировать потенциально опасные последствия для организма пациента);
- интоксикация;
- индивидуальная непереносимость ряда медикаментозных средств. В том числе анестезирующего типа;
- сердечная недостаточность в тяжелой форме.
В зависимости от количества и типа противопоказания врачом принимается решение о целесообразности проведения ЧКВ в конкретном случае. Отказ от коронарной пластики может быть временным, поскольку некоторые из перечисленных выше обстоятельств поддаются коррекции и частичному или полному устранению.
Используемые аппараты
Проводится операция стентирования сосудов сердца при помощи такого оборудования:
- рентгенологический аппарат;
- мониторы для отображения движения инструментов по сосудам;
- проводник с катетером и расширяющимся баллончиком или излучателем лазерных лучей;
- стенты – каркасы из металла, обычные или с лекарственным покрытием, инертными материалами.
Смотрите на видео о стентировании сосудов сердца:
Разновидности стентов
ЧКВ в кардиологии – это процесс, подразумевающий использование передовых изобретений. К одному из таких относится стент. Он представляет собой тонкую металлическую трубку, сформированную из мелких ячеек. После внедрения в организм стент раздувается до размеров сосуда специальным баллоном, вводимым через артерию.
Различия между его типами обусловлены многими факторами: материалом, используемыми при изготовлении, покрытием, наносимым поверхность, типом раскрытия после установки в сосуде и так далее.
Основная классификация подразумевает подразделение имплантатов на:
- Проволочные (при производстве используется 1 тип проволоки).
- Тубулярные (в основе их конструкции лежит трубка в форме цилиндра).
- Кольцевые (конструкция подразумевает наличие нескольких колец, скрепленных между собой).
- Сетчатые (внешне выглядят как сетка).
- Самораскрывающиеся (после установки в сосуд увеличиваются в нем до требуемых размеров без использования дополнительного оборудования).
- Раскрывающиеся с помощью «баллончика» (приобретают необходимый размер после «раздувания» приспособлением, вводимым через артерию).
Разновидность стента, выбранная хирургом для конкретного человека, зависит от места внедрения имплантата, а также наличия противопоказаний у самого оперируемого (например, аллергические реакции на металлический сплав).
Виды стентов
Существует несколько разновидностей стентов:
- обычные металлические без покрытия – дешевле остальных, сделаны из стали или кобальтовых, никелевых сплавов, танталовые, широко используются, а многие кардиохирурги признают их точно такими же по конечному эффекту, как и более дорогие;
- покрытые медикаментами – лекарства предупреждают воспаление, образование тромбов и нарастание ткани на стент;
- инертные – имеют напыление золота, титана или карбида кремния, не вступают в реакцию с кровью и стенками артерий;
- с двойным покрытием – одновременно предупреждают закупорку и разрастание мышечного слоя;
- саморассасывающиеся – через 36 месяцев растворяются, постепенно выделяют в кровь препараты, препятствующие закупорке сосуда.
Виды стентов
Риски вмешательства
ЧКВ, несмотря на простоту своего проведения, как и любое хирургическое вмешательство в кардиологии, подразумевает наличие ряда рисков.
Это не только отторжение организмом устанавливаемого в ходе операции стента, но и потенциально опасная возможность:
- повреждения стенки сосудов;
- возникновения беспричинных кровотечения (при чем не только внешних, но и внутренних);
- летального исхода;
- формирования тромбоза стентов;
- возникновения или прогрессирования уже существующего острого коронарного синдрома;
- развития рестеноза;
- заражения инфекцией мягких тканей;
- формирования ложных аневризмов;
- возникновения гематом (в том числе пульсирующих);
- разрыва коронарных артерий (несмотря на то, что риск возникновения такого последствия ЧКВ минимален, при таких обстоятельствах летальных исход пациента неминуем).
Несмотря на имеющиеся риски, важно понимать, что абсолютное большинство из них обусловлены не соответствующим обследованием общего состояния организма перед проведением чрескожного коронарного вмешательства.
В условиях следования рекомендациям кардиолога (врача необходимо выбирать с учетом его опыта, полученной квалификации, а также отзывов пациентов), риск возникновения непредвиденных ситуаций на операционном столе минимален.
Антикоагулянтная терапия
Всем без исключения пациентам после ЧКВ необходимо принимать препараты для снижения свертывания крови – антикоагулянты (Варфарин), тормозящие соединение тромбоцитов – антиагреганты (Плавикс, Кардиомагнил). Обычно их назначают на 1 месяц, а затем пациент проходит обследование, включающее ЭКГ с нагрузочными пробами, анализы крови, мочи, осмотр гастроэнтеролога и других специалистов при необходимости.
По полученным результатам изменяется доза, схема приема. В дальнейшем ежемесячно необходимо контролировать коагулограмму, а остальные методы диагностики рекомендуют раз в 3-6 месяцев. Препараты для разжижения крови в поддерживающей дозе нужно принимать не менее 1 года.
В медикаментозную терапию также включают таблетки для:
- снижения уровня холестерина – Крестор, Вазилип;
- нормализации тонуса сосудов и давления крови – Престариум, Диротон;
- улучшения обменных процессов в сердечной мышце – Милдронат, Предуктал.
Чем ЧКВ отличаются от открытых операций на сердце
Чрескожное коронарное вмешательство отличается от открытых операций на сердце не только большей безопасностью, но и техникой своего проведения.
Помимо этого, среди характерных черт можно также выделить:
- отсутствие необходимости помещать человека под общий наркоз на продолжительное время (с возрастом, а также ввиду наличия ряда обстоятельств пациентам бывает сложно выходить из «медикаментозного сна»);
- менее долгий реабилитационный процесс (целостность кожного покрова после чрескожного коронарного вмешательства восстанавливается уже спустя несколько недель после проведения операции);
- большое количество противопоказаний, носящих «временный характер» (например, лихорадочные состояния, отказ больного от дальнейшего сопровождения или отсутствие возможности поддерживать контакт с оперируемым);
- отсутствие необходимости длительной подготовки к проведению операции (обычно наблюдающий пациента кардиолог рекомендует сдать анализы крови на выявление патологий, а также пройти ультразвуковое исследование отдельных систем организма и получить заключение узких специалистов).
Оборудование, используемое во время проведения ЧСВ менее дорогостоящее, чем «рабочие инструменты» хирургов, работающих с открытыми операциями на сердце. Это обуславливает возможность проводить медицинские манипуляции такого типа в большинстве больниц, имеющих кардиологическое отделение.
Возможные риски
Основной риск после проведения ЧКВ – это рестеноз. Так называется повторная закупорка коронарного сосуда. Она может стать причиной возобновления боли в сердце и даже развития инфаркта. Установлены категории больных, у которых вероятность рестеноза высокая:
- курящие;
- страдающие алкоголизмом;
- женщины;
- с сахарным диабетом;
- нарушающие рекомендации по диете и физической активности;
- в возрасте от 65 лет;
- с избыточным весом тела;
- перенесшие ранее инфаркт.
Осложнения после
После операции стентирования возможны такие осложнения (помимо рестеноза):
- повышение температуры – считается нормой рост до 37,3 градусов в первые 2-3 дня, потом это признак инфицирования;
- кровотечение из бедренной артерии, где был заведен катетер;
- нарушение функции почек из-за введения контраста – боли в пояснице, учащенное мочеиспускание;
- травмирование сосуда катетером;
- аритмия, остановка сокращений сердца, инфаркт (частота ниже 1%).
Они, как правило, проявляются в ранний послеоперационный период, пока пациент находится в стационаре. После выписки опасными симптомами, требующими срочного обращения к врачу, являются:
- лихорадка,
- озноб,
- сильная боль в грудной клетке,
- жжение за грудиной,
- ощущение перебоев ритма,
- внезапная слабость,
- потливость.
Результаты проведения
В результате установки стента:
- останавливается распространение уже возникшего инфаркта или предупреждается его появление при предынфарктном состоянии;
- течение стенокардии становится легче – приступы возникают при более высокой физической нагрузке, они короче по времени, снимаются меньшей дозой медикаментов;
- у больного возрастает качество жизни, так как увеличивается активность, есть шанс полностью восстановить трудоспособность;
- понижается риск смертельного исхода от инфаркта, аритмии и сердечной недостаточности.
Жизнь после
После операции на первое время устанавливают ограничения:
- на первые сутки не рекомендуется чрезмерная физическая активность, управление автомобилем;
- на 7-10 дней под запретом ванна, подъем тяжести от 3 кг, быстрый подъем по лестнице, занятия спортом (полезна размеренная ходьба, но без появления усталости), половые контакты;
- на 30-45 дней противопоказано загорание, пребывание в сауне, переохлаждение, резкая смена климата.
В первый месяц происходит восстановление организма, необходимо постепенное расширение физической активности. Рекомендуется дозированная ходьба и лечебная, дыхательная гимнастика по 30-45 минут в день.
Ежедневно нужен контроль пульса и давления, нельзя допускать их повышение свыше 90 ударов за минуту и 130/85 мм рт. ст. Запрещено курение, злоупотребление алкоголем. Пациентам требуется снижение веса при ожирении.
Питание после ЧКВ
Диета является одним из обязательных условий реабилитационного периода, нужно исключить из рациона:
- жирное мясо (свинина, баранина, утка), субпродукты;
- все колбасные изделия;
- полуфабрикаты;
- консервы;
- копчения, соления, маринады;
- магазинные соусы;
- маргарин, сметанные и сырные продукты;
- жирные сливки, сметану и творог выше 9% жира, сливочное масло (можно до 20 г);
- нектары, сладкую газировку;
- торты, пирожные.
Разрешены:
- первые блюда из овощей и круп (без мяса и рыбы);
- отварные, паровые, запеченные овощи;
- нежирная курица и рыба (нельзя обжаривать или тушить с маслом);
- овощной салат с заправкой из трав и лимонного сока, чайной ложки растительного масла;
- фрукты, ягоды;
- цельнозерновой хлеб и с отрубями, каши, хлебцы;
- свежеприготовленные кисломолочные напитки без сахара, творог 2-5%, 1-2 столовые ложки сметаны 10% в день;
- яйца для омлета, пашот, отварные – 3 желтка в неделю, белок можно каждый день;
- бобовые – фасоль, чечевица, горох;
- семечки и орехи, мед – 1-2 столовые ложки.