Журнал «Медицинский совет» №12
/2021
DOI:
10.21518/2079-701X-2021-12-353-359
А.Г. Сыркашева
, ORCID: 0000-0002-7150-2230
Н.В. Долгушина
, ORCID: 0000-0003-1116-138X
Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова; 117997, Россия, Москва, ул. Академика Опарина, д. 4
Введение
. Бесплодие, т.е. неспособность достичь клинической беременности в течение 12 мес. регулярной половой жизни без контрацепции, является актуальной медицинской проблемой и затрагивает до 15–25% супружеских пар в западных странах.
Цель
. Оценить эффективность профилактического назначения антиоксидантов для подготовки к циклам вспомогательных репродуктивных технологий (ВРТ) в зависимости от уровня антропогенных химических веществ в организме пациентки.
Материалы и методы
. В рандомизированное клиническое исследование включены 144 пациентки с бесплодием, обратившиеся для проведения ВРТ. Перед проведением лечения методами ВРТ всем пациенткам определяли уровень антропогенных химических веществ (АХВ) в крови методом масс-спектрометрии. Определяли концентрацию следующих веществ: ртуть, кадмий, свинец, бисфенол А. Для оценки суммарного уровня АХВ была разработана условная шкала, разработанная ранее. Пациентки были разделены на группы в зависимости от уровня АХВ: группу 1 составили 72 пациентки с высоким уровнем АХВ (5 баллов и более), группу 2 составили 72 пациентки с низким уровнем АХВ. Антиоксидантную терапию в экспериментальной группе проводили в течение 2 мес. перед проведением ВРТ. В качестве антиоксидантной терапии использовали коэнзим Q10 300 мг/сут перорально, эйкозапентаеновую кислоту 300 мг/сут перорально, докозагексаеновую кислоту 200 мг/сут перорально. Все пациентки в контрольной группе не принимали антиоксидантные препараты как минимум 6 мес. до вступления в цикл ВРТ.
Результаты
. При оценке клинических исходов циклов ВРТ отмечено положительное влияние антиоксидантной терапии как у пациенток с высоким уровнем АХВ, так и пациенток с низким уровнем АХВ, в результате в группе пациенток, получавших антиоксидантную терапию, шансы наступления беременности были в 2,3 раза выше по сравнению с контрольной группой. Число пациенток, подвергаемых лечению, составило 5 как для общей группы пациентов, так и для подгрупп в зависимости от уровня АХВ.
Заключение
. Полученные результаты позволяют рекомендовать назначение антиоксидантной терапии для подготовки пациенток к программам ВРТ.
Для цитирования:
Сыркашева А.Г., Долгушина Н.В. Роль антиоксидантной терапии в повышении эффективности программ вспомогательных репродуктивных технологий. Медицинский Совет. 2021;(12):353-359. https://doi.org/10.21518/2079-701X-2021-12-353-359
Конфликт интересов:
авторы заявляют об отсутствии конфликта интересов.
The role of antioxidant therapy in enhancing the effectiveness of assisted reproductive technology programs
Anastasiya G. Syrkasheva
, ORCID: 0000-0002-7150-2230
Nataliya V. Dolgushina
, ORCID: 0000-0003-1116-138X
Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology, 4, Academician Oparin St., Moscow, 117997, Russia
Introduction
. Infertility, i.e. the inability to achieve a clinical pregnancy within 12 months of a regular sexual life without contraception, is a current medical problem and affects up to 15-25% of married couples in Western countries.
Objective
. To evaluate the efficacy of prophylactic prescription of antioxidants in preparation for cycles of assisted reproductive technology (ART) depending on the level of anthropogenic chemicals in the patient’s body.
Materials and methods
. A randomized clinical trial included 144 patients with infertility who applied for ART. Prior to ART treatment, all patients were determined the level of anthropogenic chemical substances (ACS) in the blood by mass spectrometry. The concentration of the following substances was determined: mercury, cadmium, lead, and bisphenol A. The patients were divided into groups depending on the level of ACS: group 1 consisted of 72 patients with high level of ACS (5 points or more), group 2 consisted of 72 patients with low level of ACS. Antioxidant therapy in the experimental group was performed for 2 months before ART. Coenzyme Q10 300 mg/day orally, eicosapentaenoic acid 300 mg/day orally, and docosahexaenoic acid 200 mg/day orally were used as antioxidant therapy. All patients in the control group did not take antioxidant medications for at least 6 months before entering the ART cycle.
Results
. When evaluating the clinical outcomes of ART cycles, a positive effect of antioxidant therapy was noted in both patients with high and low levels of ACS; as a result, the chances of pregnancy were 2.3 times higher in the group of patients who received antioxidant therapy compared to the control group. The number of patients treated was 5 for both the total patient group and the subgroups depending on the level of ACS.
Conclusion
. The results obtained allow us to recommend the prescription of antioxidant therapy to prepare patients for ART programs.
For citation:
Syrkasheva A.G., Dolgushina N.V. The role of antioxidant therapy in enhancing the effectiveness of assisted reproductive technology programs. Meditsinskiy sovet = Medical Council. 2021;(12):353-359. (In Russ.) https://doi.org/10.21518/2079-701X-2021-12-353-359
Conflict of interest:
the authors declare no conflict of interest.
Введение
Бесплодие, т.е. неспособность достичь клинической беременности в течение 12 мес. регулярной половой жизни без контрацепции, является актуальной медицинской проблемой и затрагивает до 15–25% супружеских пар в западных странах [1]. По некоторым данным, число супружеских пар с нарушенной фертильностью может быть вдвое больше, если учитывать сложности с вынашиванием беременности [2].
В течение последних десятилетий увеличивается потребность в использовании методов вспомогательной репродукции. К примеру, в США в 1995 г. было проведено 60 тыс. циклов вспомогательных репродуктивных технологий (ВРТ), а в 2015 г. – 209 тыс. циклов. По данным Российской ассоциации репродукции человека (РАРЧ), в 2000 г. в России было проведено 6 тыс. циклов ВРТ, а в 2021 г. – почти 146 тыс. циклов. Однако, несмотря на научные достижения последних десятилетий, эффективность программ ВРТ не превышает 30–35% и не имеет тенденции к увеличению.
Высокая распространенность бесплодия, возрастающая потребность в методах ВРТ мотивируют определять модифицируемые факторы, влияющие на репродуктивное здоровье. В последние годы большое внимание научного сообщества уделяется модификации образа жизни и ограничению контакта с вредными факторами внешней среды в рамках прегравидарной подготовки [3, 4].
Одним из современных трендов в репродуктивной медицине является назначение пероральных антиоксидантов (в основном в виде БАД) пациенткам, планирующим самостоятельную беременность или проведение циклов ВРТ. Однако данных об эффективности данных препаратов в научной литературе недостаточно. Одним из потенциальных механизмов действия антиоксидантных препаратов может быть снижение окислительного стресса. Окислительный стресс является основным патогенетическим механизмом негативного воздействия вредных факторов окружающей среды на организм человека [5]. Повышение уровня антропогенных химических веществ ассоциировано с нарушениями фертильности, так как репродуктивная система уязвима для воздействия внешних факторов [6].
Цель исследования
– оценить эффективность профилактического назначения антиоксидантов для подготовки к циклам ВРТ в зависимости от уровня антропогенных химических веществ в организме пациентки.
Антиоксиданты в терапии цереброваскулярных заболеваний
В настоящее время цереброваскулярная патология занимает второе место в ряду главных причин смертности, уступая по этому показателю лишь заболеваниям сердца и уже опережая смертность от опухолей всех локализаций. Цереброваскулярная патология является ведущей причиной инвалидизации населения и, следовательно, представляет собой одну из важнейших медицинских и социальных проблем.
На сегодняшний день в мире цереброваскулярными заболеваниями страдают около 9 млн человек. Ведущую роль среди этих заболеваний занимают инсульты, поражающие от 5,6 до 6,6 млн человек ежегодно и уносящие 4,6 млн жизней. По материалам Всемирной организации здравоохранения, частота инсульта колеблется от 1,5 до 7,4 на 1000 человек. Так, в США церебральный инсульт случается каждые 53 секунды.
В Российской Федерации и странах СНГ отмечается прогрессирующий рост заболеваемости этой патологией: примерно каждые 1,5 мин у кого-то из россиян впервые развивается инсульт. Заболеваемость инсультом в России составляет 450 000 случаев в год: только в Москве количество острых инсультов составляет от 100 до 120 случаев в сутки. Общая смертность от инсульта в 2001 г. составила 1,28 на 1000 человек (у мужчин — 1,15, у женщин — 1,38). Смертность от инсульта в нашей стране одна из самых высоких в мире: в 2000 г. стандартизированный показатель составил 319,8 на 100 000 человек. По показателям смертности Россия занимает второе место, уступая лишь Болгарии. Летальность на острой стадии всех видов инсульта составляет примерно 35%, возрастая еще на 12–15% к концу первого года. Наряду с высокой смертностью социально значимыми являются и последствия инсультов — развитие инвалидизации с утратой трудоспособности. Инвалидизация после инсульта занимает первое место среди всех причин первичной инвалидизации, так как менее 20% выживших возвращаются к прежней социальной и трудовой деятельности. Помимо этого, наносится огромный ущерб экономике, с учетом расходов на лечение, медицинскую реабилитацию, потерь в сфере производства. В США материальные затраты при инсультах составляют от 7,5 до 11,2 млн долларов в год, расходы на одного больного, учитывая необходимость длительного лечения и социальной реабилитации, составляют от 55 до 73 тыс. долларов в год.
Соотношение между ишемическим и геморрагическим инсультом ранее составляло 5:1. Данные регистра 2001 г. показали, что в России ишемические инсульты составили 79,8%, внутримозговые кровоизлияния — 16,8%, субарахноидальные кровоизлияния — 3,4%.
В России ежегодно регистрируется до 100 000 новых случаев кровоизлияний в мозг. Заболеваемость геморрагическим инсультом выше у мужчин, тогда как смертность — у женщин. По данным ряда авторов, смертность при кровоизлиянии в мозг варьирует от 38 до 93%, причем 15–35% больных умирают в течение месяца с момента заболевания, половина из них погибает в течение первых трех суток. Только 10% пациентов к концу первого месяца и 20% по истечении полугода могут обслуживать себя самостоятельно; 25–40% больных имеют умеренно выраженную степень инвалидности, 35–55% — тяжелую инвалидность.
Эпидемиологическую и демографическую ситуацию в мире по цереброваскулярной патологии в настоящее время характеризуют повсеместная распространенность этого вида патологии, «постарение» населения и увеличение частоты прогрессирующих цереброваскулярных заболеваний, «омоложение» инсультов в связи с ростом числа экстремальных факторов и воздействий (А. А. Михайленко и соавт., 1996; А. А. Скоромец, 1999). У большого числа людей в возрасте старше 50 лет процессы так называемого «нормального старения» быстро сменяются патологическими изменениями, связанными прежде всего с недостаточностью церебрального кровотока вследствие атеросклеротического поражения сосудов, снабжающих кровью головной мозг, с изменениями реологических свойств крови, приводящими к дизрегуляциям и снижению нейротрансмиттерной активности. Клинически эти нейромедиаторные и морфологические дизрегуляции проявляются тяжелыми симптомокомплексами острой и/или хронической ишемии головного мозга, требующими постоянной и эффективной коррекции.
Число пациентов с явлениями хронической ишемии головного мозга в нашей стране растет также неуклонно, как и количество больных с острыми нарушениями мозгового кровообращения, составляя не менее 700 на 100 000 человек. Если к настоящему времени в нашей стране пусть не в полном объеме, но имеется статистика по острым инсультам, то достоверных статистических данных о числе больных с хронической ишемией головного мозга нет. Это в основном пациенты амбулаторного звена, посещение поликлиники для них нередко связано с трудностями; зачастую им ставятся комплексные диагнозы, при этом цереброваскулярная патология не учитывается или относится в разряд осложнений, что затрудняет получение объективных данных. Дефицит квалифицированных кадров неврологов в амбулаторно-поликлинических учреждениях также часто ведет к неправильной трактовке данного диагноза.
В основе патоморфологических нарушений у больных с острой и хронической ишемией головного мозга лежат многообразные патогенетические факторы, такие, как атеросклероз, артериальная гипертония, а также их сочетания, кардиальная патология, изменения состояния позвоночника с компрессией вертебральных артерий, гормональные расстройства, ведущие к изменениям свертывающей системы крови, другие виды нарушений системы гемостаза и физико-химических свойств крови, влекущих за собой формирование функционально-морфологических ишемических расстройств.
Наиболее распространенными причинами формирования клинических проявлений ишемии головного мозга являются атеросклеротические стенозирующие и окклюзирующие поражения магистральных артерий головы; заболевания сердца, к которым относится прежде всего ишемическая болезнь сердца с явлениями мерцательной аритмии и высоким риском микроэмболизации в интрацеребральные сосуды. Атеросклероз — системное заболевание сосудов, приводящее к инфильтрации интимы артерий холестерином, поступающим из крови. В развитии атеросклероза имеют значение наследственная предрасположенность и конституциональные особенности. Однако основная причина широкого распространения атеросклероза в последние годы — это функциональные воздействия на высшую нервную деятельность человека, которые можно квалифицировать как отрицательные проявления урбанизации в условиях научно-технического прогресса. Они-то и приводят к длительному и систематическому нервно-психическому напряжению. Способствуют развитию атеросклероза гиподинамия и гипокинезия (труд без физического напряжения, ограничение ходьбы, пассивный характер отдыха), гипоксия (загрязнение воздуха городов), усиление воздействия внешнего электромагнитного потенциала, отрицательное влияние шума и темпов городской жизни, недостаточный сон и избыточная калорийность пищи (с учетом гипокинезии). Известное значение имеет и отмечающееся в последние годы широкое распространение курения, как фактора, способствующего развитию ангиоспазмов в различных сосудистых бассейнах. В связи с этим в последние годы о контингента больных атеросклерозом и артериальной гипертонией, в частности от 50 до 60% случаев церебральных сосудистых заболеваний приходятся на возраст от 50 до 60 лет. В то же время церебральный атеросклероз выходит на первое место по сравнению с артериальной гипертонией. Ведущее значение в развитии сосудистой церебральной патологии, в частности атеросклероза, имеют четыре из отмеченных выше фактора: нервно-психическое напряжение, гипокинезия, гиподинамия и избыточная калорийность пищи. В результате их воздействия наступает перевозбуждение коры больших полушарий и гипоталамо-гипофизарно-надпочечниковой системы, усиленный выброс катехоламинов, нарушение всех видов обмена веществ, особенно в стенках сосудов, иногда повышение артериального давления.
Изучение причин, обусловливающих заболеваемость и смертность при сосудистых заболеваниях нервной системы, привело к установлению факторов риска, которые играют способствующую роль в развитии сосудистых церебральных катастроф. К этим факторам относятся: артериальная гипертония, сосудистая гипотония, ожирение (избыточный вес), гиперхолистеринемия (особенно у лиц молодого и среднего возраста), курение, злоупотребление алкоголем, отягощенная наследственность, коронарный атеросклероз, сахарный диабет, эндокринная патология, нарушение минерального обмена (шейный остеохондроз), проживание в местностях с резкими колебаниями метеофакторов, труд с высоким интеллектуальным напряжением.
Геморрагический инсульт, также характеризующийся тяжелым вторичным ишемическим каскадом, наиболее часто возникает как осложнение артериальной гипертонии (60% случаев). Развитие дегенеративных изменений (липогиалиноз, фибриноидный некроз) в небольших перфорирующих артериях мозга и образование микроаневризм на фоне артериальной гипертонии являются наиболее важными предпосылками для возникновения гипертонического внутримозгового кровоизлияния, причем кровоизлияние развивается чаще у больных с выраженной или умеренной артериальной гипертонией, чем у больных с «мягкой» артериальной гипертонией. Патогенетически внутримозговые кровоизлияния развиваются вследствие разрыва сосуда либо путем диапедеза. Следующим по частоте этиологическим фактором кровоизлияния в мозг является разрыв артериовенозной мальформации, кровоизлияние из разорвавшихся аневризм (10–12% случаев). Возникающая чаще в пожилом возрасте церебральная амилоидная ангиопатия, образующаяся вследствие отложения аномального амилоидного белка в средней оболочке и адвентиции мелких корковых артерий и артериол, способствует возникновению милиарных аневризм и фибриноидному некрозу пораженных сосудов, которые могут разорваться при подъеме артериального давления, являясь причиной внутримозгового кровоизлияния в 10% случаев. Такие гематомы нередко бывают множественными. Длительный прием антикоагулянтов в 8–10% случаев приводит к внутримозговому кровоизлиянию, особенно при достижении гипокоагуляции, т. е. снижении протромбинового индекса до 40% или повышении международного нормализующего коэффициента до 5. Опухоль головного мозга или метастазы в мозг осложняются кровоизлияниями в них в 6–8% случаев. До 20% составляют другие причины, такие, как гемофилия, тромбоцитопения, лейкемия, геморрагический диатез, артериит, тромбоз внутричерепных вен, злоупотребление алкоголем и наркотиками, коагулопатии, васкулиты.
Механизм развития гипоксии, представляющей собой несоответствие между потребностью тканей в кислороде и его доставкой, однотипен для любых форм цереброваскулярной патологии. Он связан прежде всего с нарушением окисления субстратов в тканях организма в результате затруднения или блокады транспорта электронов в дыхательной цепи митохондрий, что приводит к повреждению мембран лизосом с выходом аутилитических энзимов в межклеточное пространство.
Стресс, точнее дистресс по теории Селье, представляет собой механизм неспецифической адаптации к изменяющимся условиям среды обитания организма.
На начальном этапе кислородного голодания в митохондриях снижается скорость аэробного окисления и окислительного фосфорилирования, что приводит к снижению синтеза белков и экспрессии генов, снижению количества аденозинтрифосфата (АТФ), увеличению аденозиндифосфата (АДФ) и аденозинмонофосфата (АМФ); уменьшается коэффициент АТФ/АДФ+АМФ. При дальнейшем снижении мозгового кровотока активируется фермент фосфофруктокиназа (ФФК), усиливается анаэробный гликолиз, а потом отмечается окончательный переход на анаэробное дыхание, что адаптирует клетку к гипоксии, однако запасы гликогена истощаются. Это, в свою очередь, влечет за собой накопление недоокисленного лактата, снижение пирувата с развитием лактатацидоза — вплоть до развития отека мозга.
При этом увеличивается активность лактатдегидрогеназы и уменьшается активность сукцинатдегидрогеназы, поставляющей электроны в дыхательную цепь митохондрий, что указывает на нарушение процессов энергообразования в ишемизированном мозге. В таких условиях анаэробный гликолиз не происходит, что приводит к тяжелому энергодефициту. На конечном уровне возникают дестабилизация клеточных мембран, нарушение работы ионных каналов, повреждение калий-натриевого насоса, калий (возбуждающий нейротрансмиттер) выходит из клетки, что делает ее менее возбудимой, а натрий избыточно поступает в клетку, за натрием по осмотическому градиенту в клетку поступает и накапливается излишнее количество воды, покидающей интерстиций, что приводит к гипергидратации клеток, мутному набуханию, а затем баллонной дистрофии. Важнейшая роль в этом процессе принадлежит глутаматным рецепторам.
Оксидантный стресс, тесно связанный с ишемическим каскадом, возникает при возбуждении глутаматных рецепторов и заключается в избыточном накоплении свободных радикалов, активации перекисного окисления липидов и избыточного внутриклеточного накопления их продукции. Реакции оксидантного стресса и ишемического каскада взаимодействуют и потенцируют друг друга.
Свободными радикалами (это молекулы с неспаренным электроном) являются высокоактивные формы кислорода, пероксид водорода, альдегиды, образующиеся в условиях гипоксии, при неполном восстановлении кислорода, изменяющие функциональные свойства ряда ферментов, углеводов, белков, в том числе дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК), в результате клетка утрачивает свои функции, появляются аномальные белки и стимулируются, помимо прямого повреждающего действия, вторичные деструктивные процессы. Кислород для любой клетки, особенно для нейрона, является основным энергоакцептором в дыхательной цепи митохондрий. Связываясь с атомом железа цитохромоксидазы, молекула кислорода подвергается четырехэлектронному восстановлению с образованием воды. Основной устойчивой формой кислорода является «триплетный» кислород, в молекуле которого оба неспаренных электрона параллельны и их валентности (спины) направлены в одну сторону. Кислород, в молекуле которого валентности направлены в разные стороны, называется синглетным, он является нестабильным и токсическим для биологических субстанций. Свободные радикалы являются нестабильными и стремятся перейти в устойчивые соединения путем спаривания свободного радикала, отрывая атом, чаще всего водорода, от другого соединения и присоединяя его к себе.
Наряду с процессами свободнорадикального окисления, в биологических объектах вырабатываются стабильные антиоксидантные радикалы, которые способны отрывать атомы водорода только от особых молекул, имеющих слабо связанные атомы водорода. Такой класс химических соединений называется антиоксидантами, поскольку механизм их действия основан на торможении свободнорадикальных процессов в тканях, что тормозит развитие деструктивных изменений, инактивирует реакции оксидантного стресса. От соотношения активности свободных радикалов и антиоксидантов зависят изменения структуры и функции субстратов, находящихся в условиях ишемии и стресса.
Необходимо отметить, что патофизиологические механизмы возникновения и прогрессирования оксидантного стресса у больных с любой формой цереброваскулярной патологии являются однотипными и характерны как для больных с ишемическим и геморрагическим инсультом, так и для пациентов с хроническими формами недостаточности мозгового кровообращения. Хроническая ишемия головного мозга — это заболевание ступенеобразно прогрессирующее на фоне повторных эпизодов дисциркуляции, приводящей к нарастанию гипоксии мозга.
Лечение церебрального инсульта складывается из общих и специфических методов. К первым относятся мероприятия по обеспечению адекватной оксигенации, коррекция артериального давления, купирование осложнений, возможных судорог, контроль за состоянием жизненно важных органов, мероприятия по уходу за больным, а также применение методов специфической терапии, стимулирующей защитные механизмы мозговой ткани в условиях острой ишемии и гипоксии. То же самое относится и к процессам коррекции хронических форм расстройств церебрального кровообращения.
Одним из наиболее перспективных методов неспецифической терапии церебрального инсульта и хронических форм нарушений мозгового кровообращения является в настоящее время применение антиоксидантов, являющихся специфическими корректорами энергетического метаболизма мозга, действующими именно в условиях ишемии и гипоксии.
В организме имеется физиологическая антиоксидантная система, сохраняющая окислительно-антиоксидантное равновесие как в жидких средах (кровь, лимфа, внутриклеточная и межклеточная жидкость), так и в структурных элементах клетки (плазматических, эндоплазматических, митохондриальных, клеточных мембранах). К ферментным антиоксидантам относятся: супероксиддисмутаза, осуществляющая инактивацию супероксидного радикала внутри клетки; каталаза, разлагающая внутриклеточный пероксид водорода; глутатиондегидроаскорбатредуктаза, некоторые другие пероксидазы.
К неферментным антиоксидантам относятся витамины С, Е, К, глюкоза, убихиноны, фенилаланин, трансферрин, гаптоглобин, триптофан, церулоплазмин, каротиноиды. Биологические и химически синтезированные антиоксиданты делятся на жирорастворимые и водорастворимые. Первые локализуются там, где расположены субстраты-мишени для атаки свободных радикалов и пероксидов, наиболее уязвимые для процессов перекисного окисления биологические структуры, к которым относятся прежде всего биологические мембраны, липопротеины крови, а основными мишенями в них являются ненасыщенные жирные кислоты. Наиболее значимый жирорастворимый антиоксидант — α-токоферол, он взаимодействует с гидроксильным радикалом ОН и оказывает подавляющее влияние на синглетный кислород, сохраняя активность мембрансвязанных ферментов. В организме α-токоферол не синтезируется, он относится к группе витаминов (витамин Е), является универсальным жирорастворимым антиоксидантом и природным иммуномодулятором, нормализуя показатели клеточного и гуморального иммунитета. Среди водорастворимых антиоксидантов наиболее важны глутатион, играющий ключевую роль в защите клеток от токсических интермедиатов кислорода, и система аскорбиновой кислоты, особенно значимая для антиоксидантной защиты мозга. Следует отметить, что в борьбе с оксидантным стрессом принимают участие и антиоксиданты, поступающие в составе пищи: минеральные вещества (соединения селена, магния, меди), некоторые аминокислоты, флаваноиды (растительные полифенолы). Однако их роль сводится к минимуму, если учесть, что в рационе современного человека преобладают рафинированные и технологически обработанные продукты, лишенные природных качеств (даже при условии преобладания в рационе продуктов растительного происхождения), что является причиной хронической недостаточности антиоксидантов в организме человека.
Наиболее адекватным синергистом и практически повсеместным спутником аскорбиновой кислоты является система фенольных соединений. Она встречается во всех растительных живых организмах, составляя 1–2% биомассы и более, и выполняет различные биологические функции.
Антиоксидантные свойства фенолов связаны с наличием в их структуре слабых фенольных гидроксильных групп, которые легко отдают свой атом водорода при взаимодействии со свободными радикалами и выступают в роли ловушек свободных радикалов, превращаясь в малоактивные феноксильные радикалы. Наибольшим разнообразием химических свойств и биологической активности характеризуются фенольные соединения с двумя и более гидроксильными группами в бензольном ядре. Такие классы фенольных соединений в физиологических условиях образуют буферную окислительно-восстановительную систему. Фенольным антиоксидантом последнего поколения является препарат олифен, в молекуле которого насчитывается более 10 фенольных гидроксильных групп, способных связывать большое число свободных радикалов.
В настоящее время в клинической практике применяются α-токоферол, аскорбиновая кислота, метионин, церуллоплазмин, каротин, убихинон, эмоксипин. Однако недостатком этих препаратов является необходимость длительного использования (в течение нескольких недель) для достижения в конечном итоге слабовыраженного антиоксидантного и антигипоксантного эффекта. Это дало основание для поиска и изучения новых синтезированных антиоксидантов.
В последние годы широко изучается действие янтарной кислоты, ее солей и эфиров, представляющих собой универсальные внутриклеточные метаболиты. Янтарная кислота, содержащаяся во всех тканях и органах, является продуктом 5-й и субстратом 6-й реакции цикла трикарбоновых кислот. Окисление янтарной кислоты в 6-й реакции осуществляется с помощью сукцинатдегидрогеназы. Выполняя каталитическую функцию по отношению к циклу Кребса, янтарная кислота снижает в крови концентрацию других продуктов цикла — лактата, пирувата, цитрата, продуцируемых и накапливающихся на ранних стадиях гипоксии, и тем самым включается в энергетический обмен, направляя процесс окисления по наиболее экономичному пути. Феномен быстрого окисления янтарной кислоты сукцинатдегидрогеназой, сопровождающийся АТФ-зависимым восстановлением пула пиримидиновых динуклеотидов, называется монополизацией дыхательной цепи. Биологическое значение данного феномена заключается в быстром ресинтезе АТФ. В нервной ткани функционирует цикл Робертса, или так называемый γ-аминобутиратный шунт, в ходе которого из γ-аминомасляной кислоты (ГАМК) через промежуточную стадию янтарного альдегида образуется янтарная кислота. Образование янтарной кислоты возможно также в условиях гипоксии и окислительного стресса в реакции окислительного дезаминирования α-кетаглутаровой кислоты в печени. Антиоксидантное действие янтарной кислоты связано с ее влиянием на транспорт медиаторных аминокислот, а также с увеличением содержания в мозге аминомасляной кислоты за счет шунта Робертса. Янтарная кислота в организме нормализует содержание медиаторов воспаления гистамина и серотонина, повышает микроциркуляцию в органах и тканях, прежде всего в мозге, не оказывая влияния на артериальное давление и показатели работы сердца. Антигипоксантный эффект янтарной кислоты связан с активацией сукцинатдегидрогеназного окисления и с восстановлением активности цитохромоксидазы — ключевого окислительно-восстановительного фермента дыхательной цепи.
В настоящее время широко используются производные янтарной кислоты — отечественные препараты реамберин, цитофлавин, мексидол.
Мексидол является антиоксидантом, мембранопротектором, антигипоксантом прямого энергизирующего действия, ингибирующим свободные радикалы, уменьшающим активацию перекисного окисления липидов, повышающим активность собственной физиологической антиоксидантной системы, активирующим энергосинтезирующие функции митохондрий и улучшающим энергетический обмен в клетке. Мексидол оказывает модулирующее влияние на мембрансвязанные ферменты, ионные каналы, рецепторные комплексы, в том числе ГАМК и ацетилхолиновые, улучшает синоптическую передачу в мозговых структурах, корригируя расстройства в микроциркуляторных системах. Мексидол действует в условиях ишемии и гипоксии как специфическая ловушка свободных радикалов, снижая их повреждающее действие на церебральные структуры. Препарат назначают в дозах от 200 до 500 мг в сутки внутривенно капельно на физиологическом растворе или внутримышечно.
Дезинтоксикационный 1,5% раствор для инфузий реамберин, в состав которого входят соль янтарной кислоты и микроэлементы (магния хлорид, калия хлорид, натрия хлорид), обладает антиоксидантным, антигипоксантным, энергопротективным эффектами, уменьшает продукцию свободных радикалов, положительно влияет на аэробные процессы в период ишемии и гипоксии, восстанавливает энергетический потенциал клетки, утилизирует жирные кислоты и глюкозу в клетках, нормализует кислотно-щелочной баланс и газовый состав крови. Реамберин с успехом используется как инфузионный раствор при критических состояниях, связанных с поражением головного мозга, а также при любых состояниях, обусловленных эндо- и экзотоксикозами (церебральных инсультах, делириозных и предделириозных состояниях, отравлениях, инфекционных заболеваниях, клинических проявлениях системной воспалительной реакции, печеночной недостаточности, панкреонекрозах, перитонитах). Стандартная дозировка составляет до 800 мл (по 400 мл 2 раза) в сутки внутривенно капельно. Препарат может служит базовым инфузионным раствором для применения других лекарственных веществ.
Цитофлавин — метаболический корректор и энергопротектор, антиоксидант, антигипоксант, направленный на нормализацию состояний, сопровождающихся нарушением свободнорадикального гомеостаза, оказывающий выраженное противоишемическое действие, снижая интенсивность перекисного окисления липидов, стимулируя систему антиоксидантной защиты. Цитофлавин представляет собой сбалансированный комплекс двух метаболитов (янтарная кислота, рибоксин) и двух коферментов витаминов — рибофлавина (В2) и никотинамида (РР). Входящие в состав этого комплексного препарата действующие субстанции отличаются высоким уровнем влияния на метаболизм нейрональных структур и выступают как эффективные корректоры его дисбаланса в условиях ишемии, гипоксии и оксидантного стресса. Так, рибофлавина мононуклеотид — кофермент, активирующий сукцинатдегидрогеназу — флавопротеин, используемый для активации альтернативных NAD (Nicotinamide Adenine Dinucleotide)-зависимых метаболических путей, обладает прямым антигипоксическим действием, связанным с увеличением активности флавинредуктаз и восстановлением уровня АТФ и креатинфосфата (макроэргов). Доказано, что рибофлавин проникает через мембрану клеток вне зависимости от pH. Его поступление внутрь клетки зависит лишь от величины трансмембранного потенциала. Рибофлавин стимулирует утилизацию янтарной кислоты, активируя систему митохондриального транспорта дикарбоновых кислот цикла Кребса через челночный (глицеролфосфатный) путь, а янтарная кислота, в свою очередь, повышает трансмембранный потенциал, увеличивая транспорт рибофлавина через мембраны. Кроме того, рибофлавин повышает активность дегидрогеназ, предотвращая ишемическое повреждение нервной ткани, и ингибирует перекисное окисление липидов в тканях, спровоцированное ионами железа Fe2+.
Рибоксин (инозин) обладает выраженным антиоксидантным действием, которое реализуется комплексом взаимосвязанных метаболических путей, стимулируя активацию синтеза NAD в митохондриях из никотинамида и стимулируя анаэробный гликолиз с образованием лактата и NAD. Он характеризуется нейропротекторным эффектом при реперфузионном синдроме, потенцируя вазодилатирующее действие аденозина и ингибируя фермент аденозиндезаминазу.
Никотинамид — нейропротектор, один из фрагментов NAD, активирует NAD-зависимые ферменты клеток, в том числе антиоксидантные системы убихиноновых оксиредуктаз, защищающих мембраны клеток от разрушения радикальным частицами. Никотинамид — селективный ингибитор фермента поли-АДФ-рибозо-синтетазы, образующегося в условиях ишемии и приводящего к дисфункции внутриклеточных белков с последующим апоптозом клеток.
Янтарная кислота как антиоксидант дезактивирует пероксидазы в митохондриях, повышает активность NAD-зависимых ферментов. Никотинамид и рибофлавин, в свою очередь, повышают фармакологическую активность янтарной кислоты. Препарат вводится в дозе 10–20 мл в сутки внутривенно капельно медленно на физиологическом растворе или на 5% глюкозе. При тяжелых состояниях, связанных с диффузной гипоксией, реанимационных мероприятиях, постреперфузионном синдроме дозировка препарата может быть увеличена до 40 мл в сутки, показано внутривенное медленное капельное введение (60 капель в минуту).
В ходе многочисленных пилотных и плацебо-контролируемых исследований было выявлено положительное влияние включения вышеперечисленных антиоксидантов (цитофлавина, реамберина и мексидола) в комплексную терапию больных с церебральными инсультами и хроническими формами расстройств мозгового кровообращения. Исследования последних лет показали целесообразность комплексного применения данных препаратов в терапии расстройств мозгового кровообращения, так как мексидол и цитофлавин имеют различные точки приложения и их совместное применение может способствовать коррекции энергетических процессов в мозговой ткани с одновременной утилизацией продуктов свободнорадикального окисления.
В отношении цитофлавина, кроме того, показана высокая эффективность в терапии больных с внутримозговыми кровоизлияниями, характеризующимися особенно высоким уровнем оксидантного стресса. Выявлена четкая зависимость влияния терапии цитофлавином и размера внутримозговой гематомы. При включении цитофлавина в комплексную терапию внутримозговых кровоизлияний отмечается наиболее значительный регресс расстройств сознания, особенно выраженный при гематомах размерами 10–30 см3, более быстрый регресс очагового неврологического дефицита, лучший функциональный исход.
Для всех современных антиоксидантов доказана четкая зависимость степени эффективности от сроков начала терапии. Максимальный клинический эффект может быть достигнут при начале терапии в период от 2 до 6 ч от момента церебральной катастрофы. Менее яркий, но реальный клинический эффект в виде активации сознания, уменьшения очаговой неврологической симптоматики наблюдается при начале терапии в период до 24 ч.
У больных с хронической ишемией длительная плановая терапия антиоксидантами значимо корригирует качество жизни и позволяет предотвратить прогрессирование функционально-морфологических церебральных расстройств.
Ранняя терапия антиоксидантами в настоящее время рассматривается как реальный патогенетически обусловленный метод коррекции церебрального метаболизма при сосудистых церебральных расстройствах.
С. А. Румянцева
,
доктор медицинских наук, профессорА. А. Кравчук Е. В. СилинаРГМУ, ГКБ № 15, Москва
Материалы и методы
В рандомизированное клиническое исследование включены 144 супружеские пары, обратившиеся для лечения бесплодия с помощью ВРТ в период с 2021 по 2021 г., с отсутствием противопоказаний к проведению ВРТ, подписанным информированным согласием на участие в исследовании. Критериями включения явились нормальный кариотип обоих супругов, отсутствие выраженной патозооспермии (100% тератозооспермия, абсолютная астенозооспермия, все виды азооспермии), возраст женщины от 18 до 39 лет включительно, индекс массы тела женщины от 19 до 25 кг/м2 включительно. Критериями исключения явились использование донорских гамет или суррогатного материнства, а также получение 3 и менее ооцитов в день трансвагинальной пункции яичников. Все пациентки постоянно проживали на территории г. Москвы в течение последних 5 лет.
Все включенные в исследование супружеские пары были обследованы согласно приказу Минздрава России №107н от 30.08.2012 «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [3]. Перед проведением лечения методами ВРТ всем пациенткам определяли уровень антропогенных химических веществ (АХВ) в крови методом масс-спектрометрии. Для оценки суммарного уровня АХВ была разработана условная шкала, разработанная ранее (табл. 1
). Пациентки были разделены на группы в зависимости от уровня АХВ: группу 1 составили 72 пациентки с высоким уровнем АХВ (5 баллов и более), группу 2 составили 72 пациентки с низким уровнем АХВ. После разделения пациенток на группы в зависимости от уровня АХВ (высокий/низкий) была проведена их рандомизация для оценки эффективности антиоксидантной терапии.
Группа 1, высокий уровень АХВ (n = 72):
- группа 1а, антиоксидантная терапия+ (n = 36);
- группа 1б, антиоксидантная терапия– (n = 36). Группа 2, низкий уровень АХВ (n = 72);
- группа 2а, антиоксидантная терапия+ (n = 36);
- группа 2б, антиоксидантная терапия– (n = 36).
Антиоксидантную терапию в экспериментальной группе проводили в течение 2 мес. перед проведением ВРТ. Для этого использовали коэнзим Q10 300 мг/сут перорально, эйкозапентаеновую кислоту 300 мг/сут перорально, докозагексаеновую кислоту 200 мг/сут перорально. Все пациентки в контрольной группе не принимали антиоксидантные препараты как минимум 6 мес. до вступления в цикл ВРТ.
Овариальная стимуляция проводилась по протоколу с антагонистами гонадотропин-рилизинг-гормона, доза гонадотропинов была подобрана индивидуально. Триггер овуляции вводили при наличии в яичниках фолликулов диаметром 17 мм и более. В качестве триггера овуляции использован хорионический гонадотропин человека (ХГ) 8000–10 000 МЕ или агонист гонадотропин-рилизинггормона 0,2 мг. Поддержка лютеиновой фазы и посттрансферного периода у всех пациенток проведена по стандартному протоколу [7].
Оплодотворение ооцитов осуществляли с помощью интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ). Культивирование и перенос эмбриона проводили согласно принятым в клинической практике методикам. Долю зрелых ооцитов учитывали как отношение ооцитов на стадии M2 к общему числу полученных ооцитов. Под частотой фертилизации понимали отношение зигот с нормальным оплодотворением к общему числу ооцитов на стадии М2. Бластоцисты отличного качества – эмбрионы классов 4АА, 5АА и 6АА по классификации Гарднера [8]. Во всех случаях был осуществлен селективный перенос эмбриона в нативном цикле.
Через 14 дней после переноса в полость матки определялась концентрация ß-ХГ в сыворотке крови пациентки. При визуализации сердцебиения эмбриона через 5 нед. после переноса эмбриона регистрировали клиническую беременность. Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Данные с нормальным распределением представлены как среднее значение (стандартное отклонение). Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных, t-теста для сравнения средних величин. Различия между статистическими величинами считали статистически значимыми при уровне р < 0,05. Исследование было одобрено комиссией по этике «НМИЦ АГП им. академика В.И. Кулакова».
Введение
Хроническая цереброваскулярная недостаточность – один из наиболее распространенных синдромов в клинической неврологии, в т.ч. среди лиц трудоспособного возраста. Терминология ангиоцеребральной патологии дискутабельна, имеет место признание правомочности понятия «дисциркуляторная энцефалопатия», являющегося более общим определением патогенетических процессов, лежащих в основе повреждения мозга сосудистой природы, в т.ч. и ишемию, и микрогеморрагию, и нарушения ликвородинамики, и нейрогенную регуляцию микроциркуляторного русла. В то же время в существующей классификации болезней системы кровообращения остается устойчивым термин «хроническая ишемия мозга» (ХИМ), являющийся «зонтичным» диагнозом, объединяющим этиологически и патогенетически разнородную группу клинических состояний, которые развиваются в результате сосудистого поражения головного мозга (ГМ), не связанного с перенесенными инсультами [1–3].
Этиологические факторы развития ХИМ можно разделить на генетические (наличие аллели эпсилон-4 гена АРОЕ, церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией – CADASIL), социально-демографические (возраст старше 60 лет, монголоидная или негроидная раса, мужской пол, низкий образовательный уровень), общие факторы риска развития сосудистых заболеваний (артериальная гипертензия [АГ], ишемическая болезнь сердца, ортостатическая гипотензия, сахарный диабет, гиперхолестеринемия, гипергомоцистеинемия, ожирение), прочие (курение, алкоголизм, сонные апноэ) [4–6].
Как показывают результаты многих исследований, именно когнитивные нарушения (КН) представляют собой наиболее раннее и объективное проявление хронической сосудистой патологии ГМ, поэтому примерную оценку распространенности ХИМ можно сделать на основании проведенных в западных странах исследований распространенности сосудистых КН. По данным различных исследователей, цереброваскулярные КН выявляются у 5–22% пожилых лиц [1]. При аутопсии те или иные сосудистые изменения, чаще всего микроваскулярной природы, обнаруживают примерно у трети пожилых людей. Таким образом, общая распространенность хронической цереброваскулярной патологии может составлять около трети пожилых лиц.
Важнейшие в развитии ХИМ – по-прежнему сосудистые факторы риска [7]: АГ, дислипидемия, сахарный диабет, фибрилляция предсердий, избыточная масса тела/ожирение. Наблюдается взаимосвязь этих факторов, их одновременное наличие значительно увеличивает риск появления и прогрессирования КН [8]. Безусловно, немаловажную роль в развитии и прогрессировании ХИМ играют ишемическая болезнь сердца, сопровождающаяся хронической сердечной недостаточностью, гемостатические нарушения, венозная дисциркуляция, артериальная гипотония, курение, злоупотребление алкоголем [8]. При этом может формироваться поражение как мелких артерий, так и крупных артериальных стволов либо их сочетание. При преимущественном поражении артерий мелкого калибра развивается либо фокальное поражение, либо диффузное повреждение мозговой ткани в виде формирования микроинфарктов и лейкоареоза. Изменения крупных артерий приводят к формированию территориальных и «водораздельных» инфарктов мозга. Перечисленные факторы риска, имеющиеся у пациентов, способствуют развитию гемодинамических и гемореологических нарушений [9].
Основные патогенетические механизмы ишемии ГМ составляют «ишемический каскад», включающий снижение мозгового кровотока, нарастание глутаматной эксайтотоксичности, накопление кальция и лактатацидоз, активацию внутриклеточных ферментов, местного и системного протеолиза, возникновение и прогрессирование антиоксидантного стресса, экспрессию генов раннего реагирования с развитием депрессии пластических белковых и снижением энергетических процессов, отдаленные последствия ишемии (локальная воспалительная реакция, микроциркуляторные нарушения, повреждения гематоэнцефалического барьера).
Характер и выраженность клинических нарушений при ХИМ зависят от локализации, объема пораженной ткани и количества очагов, при этом мнестические расстройства, как правило, не доминируют в клинической картине [10]. В подобной ситуации становится актуальным ранжирование стадий ХИМ в зависимости от выраженности патоморфологических изменений ГМ.
Для диагностики ХИМ целесообразно использовать соответствующие критерии [5]: 1) объективно выявляемые нейропсихологические и/или неврологические симптомы; 2) признаки цереброваскулярного заболевания, включающие факторы риска и/или инструментально подтвержденные признаки поражения мозговых сосудов (например, данные дуплексного сканирования), и/или вещества ГМ (данные КТ/МРТ); 3) наличие причинно-следственной связи между сосудистым поражением мозга и клинической картиной заболевания; 4) отсутствие признаков других заболеваний, способных объяснить клиническую картину.
Патогенетическая терапия ХИМ должна быть направлена на оптимизацию мозгового кровотока и создание нейрометаболической защиты ГМ от ишемии и гипоксии. Лечение пациентов с ХИМ в первую очередь предполагает контроль сосудистых факторов риска, профилактику инсульта и прогрессирования хронической цереброваскулярной патологии и, следовательно, на улучшение когнитивных функций. Профилактика инсульта основывается на коррекции факторов его риска (курение, злоупотребление алкоголем, низкая физическая активность, ожирение), лечении АГ и сахарного диабета [11]. Рекомендуется регулярная физическая активность в виде прогулок и лечебной гимнастики, интенсивность и длительность которых зависят от функционального состояния пациента, наличия сопутствующих заболеваний; во многих случаях может быть полезным плавание. В рацион питания рекомендуется включать большое количество фруктов и овощей, обладающих антиоксидантными свойствами [12].
Комплексная терапия ХИМ включает назначения антиоксидантов, антиагрегантов, препаратов, оптимизирующих метаболизм ГМ, вазоактивных препаратов. Антидепрессанты назначаются при выраженных астенодепрессивных проявлениях заболевания. Аналогичным образом назначаются антиастенические препараты.
Важным компонентом лечения ХИМ является назначение препаратов, обладающих антиоксидантной активностью. В настоящее время в клинической практике используются следующие препараты данного ряда: мексидол, троллокс, токоферола ацетат, токоферола сукцинат, эксифон, тирилазад, меклофеноксат, атеровит, эбселен, тиотриазолин, эмоксипин, цитофлавин, глутоксим [13].
Клинические исследования [14] выявили перспективность использования этилметилгидроксипиридина сукцината для ослабления проявлений астенического синдрома, психоэмоциональных расстройств и кохлеовестибулярных нарушений у пациентов с ХИМ. Препапат способствовал уменьшению инсулинорезистентности, гипертриглицеридемии, гипергликемии у пациентов с цереброваскулярными заболеваниями и метаболическим синдромом [15].
Цель исследования: изучение эффективности и безопасности терапии антиоксидантным препаратом этилметилгидроксипиридина сукцинат в дозе 250 мг 3 раза день в течение 60 дней для пациентов с ХИМ на фоне АГ и атеросклероза.
Задачи исследования: 1) оценить эффективность этилметилгидроксипиридина сукцината 250 мг в составе комплексной терапии пациентов с ХИМ на фоне стандартной терапии в течение 60 дней при пероральном введении по сравнению с контролем; 2) оценить безопасность этилметилгидроксипиридина сукцината 250 мг в составе комплексной терапии пациентов с ХИМ на фоне стандартной терапии в течение 60 дней при пероральном введении по сравнению с контролем; 3) изучить влияние курсового парентерального и перорального приемов этилметилгидроксипиридина сукцината 250 мг на динамику неврологических и психоневрологических проявлений ХИМ в сравнении с контролем.
Методы
В исследование были включены 40 пациентов в возрасте 45–75 лет, имевших диагноз ХИМ, верифицированный методами нейровизуализации (КТ или МРТ ГМ), с признаками стабильного течения заболевания не менее месяца до скрининга, при наличии АГ, атеросклероза, отсутствии лекарственной терапии препаратами вазоактивного, ноотропного, нейротрофического, нейрорегенерационного и антиоксидантного действий, в т.ч. с действующим веществом этилметилгидроксипиридина сукцинат, за 3 месяца до включения в исследование. Критерии исключения: возраст менее 45 и более 75 лет, наличие развития инсульта за 6 месяцев до включения в исследование, наличие развития инфаркта миокарда за 6 месяцев до включения в исследование, плохо контролируемая АГ с цифрами артериального давления более 200/100 мм рт.ст., наличие деменции, сахарного диабета, застойной сердечной недостаточности функционального класса II и более, выраженной печеночной и почечной недостаточности, онкологических заболеваний; прием вазоактивных, ноотропных, нейротрофических, нейрорегенерационных и антиоксидантных препаратов за 3 месяца до включения в исследование, беременность и лактация, установленная гиперчувствительность к этилметилгидроксипиридина сукцинату, злоупотребление алкоголем, участие в других клинических исследованиях, наличие других симптомов/заболеваний, по мнению исследователя, способных препятствовать участию пациента в исследовании или влиять на результаты тестов.
Всем пациентам, включенным в исследование, помимо объективных методов обследования (артериальное давление, частота сердечных сокращений и др.), подробного неврологического исследования проводилась оценка динамики субъективных жалоб пациентов с использованием шкалы Общего клинического впечатления клинициста (Clinical Global Impression; CGI, W. Guy, 1976), монреальской шкалы оценки когнитивых функций (МоСа, Z. Nasreddine, 2004), субъективной шкалы оценки астении (MFI 20, E.M. Smets et al., 1994), шкалы Гамильтона для оценки тревоги (HARS, M. Hamilton, 1959) и шкалы депрессии Гамильтона, а также оценки двигательной активности пожилых (шкала Тинетти, M. Tinetti,1986).
Пациенты, включенные в исследование, были рандомизированы в две группы методом конвертов. Пациентам 1-й (основной) группы (20 человек) назначался этилметилгидроксипиридина сукцинат перорально в дозе 250 мг 3 раза сутки в течение 60 дней от начала включения в исследование; пациентам 2-й (контрольной) группы проводилась коррекция имевшихся факторов риска (гипотензивная, гиполипидемическая, антиагрегантная или антикоагулянтная терапия, коррекция эмоционального статуса) в соответствии с принятыми клиническми рекомендациями, проколами ведения АГ, атеросклероза, ХИМ.
Все пациенты подписали информированное согласие на включение в исследование.
Статистическая обработка его результатов проводилась с использованием пакета прикладных программ Статистика 8.0. Степень статистической значимости различий несвязанных групп оценивалась с использованием непараметрического критерия Манна–Уитни. Степень статистической значимости различий между связанными группами оценивалась с использованием непараметрического критерия Вилкоксона. Различия считались значимыми при уровне р<0,05.
Результаты исследования
Исследование проводилось на базе кафедры нервных болезней с курсом медицинской реабилитации Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого с 01.04.2019 по 01.07.2019. Исследование прошло этическую экспертизу в локальном этическом комитете КрасГМУ.
При обследовании пациентов на момент включения в исследование получены следующие результаты: включены 40 пациентов, из них 29 (72,5%) женщин и 11 (27,5%) мужчин в возрасте от 52 до 72 лет, медиана возраста составила в первой группе 59,1 [56; 71] года, во второй – 58,9 [57; 70]. Группы не различались по половозрастному составу, выраженности сосудистых факторов риска.
Пациенты 1-й и 2-й групп предъявляли жалобы на головную боль в 72 и 66% случаев соответственно, головокружение – в 38 и 32%, на шаткость – в 12 и 16%, на изменения настроения в 56 и 34%, снижение памяти, концентрации внимания – в 23 и 30% случаев.
По оценке состояния на момент включения в исследования по клиническим шкалам получены данные, представленные в табл. 1.
Как видно из представленных данных, группы были однородными по степени выраженности жалоб, а также вестибуло-атактических, астенических, когнитивных, эмоционально-волевых нарушений. Степень выраженности астении в обеих группах соответствовала клинически выраженной, у пациентов основной и контрольной групп эмоционально-волевые нарушения соответствовали симптоматической тревоге, легкой степени депрессии, уровень КН – умеренным расстройствам в обоих группах, двигательная активность по шкале Тинетти соответствовала на момент включения в обоих группах ее умеренному снижению.
Повторное обследование пациентов через 2 недели лечения обнаружило удовлетворительную переносимость терапии, случаев отмены приема тестируемого препарата из-за непереносимости в основной группе не отмечено, у 3 человек основной группы и 1 – контрольной появилась умеренная головная боль, не требовавшая приема дополнительной терапии, изменения схемы лечения. При этом у ряда пациентов жалобы уменьшились: так, на 2-й неделе лечения пациенты 1-й и 2-й групп предъявляли жалобы на головную боль в 68 и 65% случаев соответственно, на головокружение – в 28 и 33%, на шаткость – в 12 и 16%, на изменения настроения – в 30 и 24%, на снижение когнитивных функций – в 24 и 30% случаев.
При повторном тестировании по набору используемых шкал были получены показатели, представленные в табл. 2.
Повторная оценка по шкалам свидетельствует о тенденции к улучшению по шкале равновесия Тиннети, шкале Гамильтона для оценки тревоги и депрессии, шкале общего клинического впечатления. Комплаентность пациентов в обеих группах была высокой, рекомендовано продолжение терапии.
При повторной оценке состояния пациентов в конце курса лечения (через 2 месяца терапии) произошли его следующие изменения: в 1-й и 2-й группах число больных, жаловавшихся на головную боль, уменьшилось на 60 и 5% соответственно, на головокружение – на 50 и 15% соответственно, на шаткость – на 70 и 10%, изменения настроения – на 80 и 27%, КН – на 50 и 12%.
При использовании набора валидизированных шкал получены данные, представленные в табл. 3.
Как следует из представленных данных, в результате лечения препаратом этилметилгидроксипиридина сукцинат 250 мг в основной группе значительно снизилась выраженность симптомов астении по субъективной шкале ее оценки MFI-20 от исходной выраженной астении с медианой 48 [47; 57] до нормальных показателей – 16 [10; 17] (р<0,0001, критерий Вилкоксона), при этом антиастенический эффект препарата проявлялся уже на ранних этапах лечения. Оценка когнитивных функций в конце лечения показала усиление психической работоспособности и темпа выполнения заданий, при этом показатели Монреальской шкалы оценки когнитивных функций имели позитивную динамику в основой группе заболевания с медианой при включении в исследование – 22 [20; 25], в конце курса лечения – 24 [21; 26] (р=0,026, критерий Вилкоксона).
Регресс жалоб на головокружение и шаткость в конце лечения сопровождались повышением оценки двигательной активности пожилых по шкале Тинетти от умеренной степени нарушения при включении в исследование (32 [23; 33]) до легкой степени в конце курса терапии: 37 [28; 38] (р<0,001, критерий Вилкоксона).
Оценка обследуемых пациентов обеих групп по шкале общего впечатления обнаружило преимущество в основной группе больных (р=0,047, критерий Манна–Уитни), прошедших лечение с использованием препарата этилметилгидроксипиридина сукцинат 250 мг по сравнению с пациентами, получавшими лечение в рамках коррекции факторов риска в соответствии с общепринятыми стандартами ведения АГ и атеросклероза.
Обсуждение
Хронические цереброваскулярные заболевания – состояния, с которыми наиболее часто приходится сталкиваться врачам различных специальностей в повседневной практике, поэтому научные исследования данной проблемы не теряют своей актуальности. Разнообразные патологические состояния, лежащие в основе развития ХИМ, предопределяют формирование ангиоэнцефалопатии, которая проявляется различными нервно-психическими расстройствами, в зарубежной литературе нередко выделяемыми в качестве самостоятельных нозологических форм, например мультиинфарктная лейкоэнцефалопатия, болезнь Бинсвангера и др. Патогенетическая терапия ХИМ должна быть направлена на оптимизацию мозгового кровотока и создание нейрометаболической защиты ГМ от ишемии и гипоксии. Вот почему наряду с коррекцией сосудистых факторов риска внимание исследователей привлекают препараты антиоксидантного действия.
Этилметилгидроксипиридина сукцинат, изучен и разработан в НИИ фармакологии РАМН и Всесоюзном научном центре по безопасности биологически активных веществ [16]. Препарат обладает широким спектром фармакологических эффектов, оказывает антиоксидантное, антигипоксантное, анксиолитическое, антистрессорное, противоалкогольное, противосудорожное, нейропротективное, ноотропное, антимнестическое, нейропсихотропное, кардиопротективное, антиатеросклеротическое, антиагрегантное, противопаркинсоническое, вегетотропное действия. Клинические исследования [17–19] продемонстрировали достоверные терапевтические эффекты препарта при лечении неврологических, психических и сердечно-сосудистых заболеваний.
Так, этилметилгидроксипиридина сукцинат проявил эффективность при лечении невротических и неврозоподобных расстройств, различных состояний при алкоголизме, в т.ч. абстинентного синдрома, а также острых и хронических нарушений мозгового кровообращения (инсульт, дисциркуляторная энцефалопатия, вегетососудистая дистония), нарушений функций ГМ при старении и атеросклерозе.
Существенным преимуществом препарта являются широкий спектр его фармакологических эффектов, низкая токсичность, практическое отсутствие побочных эффектов (типичных, например, для некоторых «стандартных» нейропсихотропных препаратов), седативного, миорелаксантного, возбуждающего и эйфоризирующего действий [18].
Заключение
В настоящей работе представлены результаты применения этилметилгидроксипиридина сукцината в дозировке 250 мг 3 раза в день в течение 2 месяцев пациентами с ХИМ, вызванной АГ и атеросклерозом. Результаты применения препарата свидетельствуют об эффективности лечения основных неврологических, нейропсихиатрических симптомов ХИМ, таких как головокружение, атаксия, КН, тревога и астения. В результате лечения препаратом этилметилгидроксипиридина сукцинат 250 мг в основной группе имело место значительное снижение выраженности симптомов астении по субъективной шкале оценки MFI-20, при этом антиастенический эффект проявлялся уже на ранних этапах лечения. Оценка когнитивных функций в конце лечения показала усиление психической работоспособности и темпа выполнения заданий по данным Монреальской шкалы оценки когнитивных функций, регресс жалоб на головокружение и шаткость в конце лечения сопровождался повышением оценки двигательной активности у пожилых по шкале Тинетти. На протяжении 2 месяцев препарат демонстрировал безопасность при использовании в указанной дозировке. Выявленные побочные эффекты были кратковременными и незначительными.
Результаты
В исследование были включены 144 пациентки, которые были разделены на группы в зависимости от уровня АХВ в организме и назначения антиоксидантной терапии. Клиническая характеристика пациенток, включенных в исследование, представлена в табл. 2
. При сравнении клинико-анамнестических характеристик различий между подгруппами не выявлено.
При оценке параметров овариальной стимуляции (длительность стимуляции, суммарная и ежедневная доза гонадотропинов, частота использования различных препаратов) различий также не было выявлено.
Затем оценили параметры фолликуло-, оо- и раннего эмбриогенеза в группах сравнения.
В группе пациенток, имевших низкий уровень поллютантов и получавших антиоксидантную терапию, наблюдали снижение числа фолликулов и ооцитов. Медиана числа фолликулов составила 8 в группе 2а по сравнению с 10 в группе 1а, 11 в группе 1б и 12 в группе 2б (р = 0,0645). Медиана числа ооцитов составила 7 в группе 2а по сравнению с 9 в группе 1а, 10 в группе 1б и 9 в группе 2б (р = 0,0276). В группе пациенток, имевших высокий уровень поллютантов и получавших антиоксидантную терапию, наблюдали снижение частоты фертилизации: медиана частоты фертилизации в группе 1а составила 90,9 по сравнению с 100 в группах 1б, 2а и 2б (р = 0,0973); табл. 3
.
При оценке клинических исходов циклов ВРТ наблюдали повышение частоты наступления клинической беременности и живорождения в группах с использованием антиоксидантной терапии (табл. 4
). При внутригрупповом сравнении (группа 1а/1б и 2а/2б) данные различия не достигли статистической значимости.
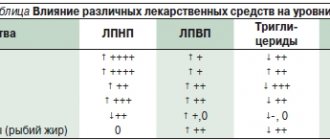
Таблица 1. Шкала оценки суммарного уровня поллютантов в организме
| Поллютант | ≥50%, 1 балл | ≥75%, 2 балла | ≥97,5%, 3 балла |
| Свинец, мкг/л | 9,85 | 13,59 | 35,36 |
| Кадмий, мкг/л | 0,32 | 0,45 | 1,45 |
| Ртуть, мкг/л | 0,81 | 1,44 | 4,50 |
| Бисфенол А, нг/мл | 0,52 | 0,66 | 12,65 |
Таблица 2. Клиническая характеристика пациенток в группах сравнения
| Группа 1а, n=36 | Группа 1б, n=36 | Группа 2а, n=36 | Группа 2б, n=36 | р** | |
| Возраст, лет* | 32 (28–34) | 32 (29–35) | 31 (28–33) | 30 (28–33) | 0,3896 |
| ИМТ, кг/м2* | 21,7 (19,8–23,0) | 21,6 (20,4–23,8) | 21,2 (20,0–23,5) | 21,5 (20,6–22,5) | 0,8618 |
| Число беременностей в анамнезе | 0 (0–1) | 1 (0–1) | 0 (0–1) | 0 (0–1) | 0,8616 |
| Первичное бесплодие, n (%) | 18 (50,0) | 18 (50,0) | 21 (58,3) | 19 (52,8) | 0,8821 |
| Длительность бесплодия, лет* | 4 (2–6) | 4 (3–5) | 4 (2–5) | 4 (2,5–6) | 0,7340 |
| Число циклов ВРТ в анамнезе | 0 (0–1) | 0 (0–1) | 0 | 0 (0–1) | 0,0591 |
| АМГ, нг/мл* | 3,1 (1,4–5,5) | 2,8 (1,5–5,8) | 2,9 (1,9–6,3) | 3,9 (2,3–6,9) | 0,2624 |
| ФСГ, мМЕ/мл* | 6,1 (4,7–7,6) | 6,7 (5,2–7,5) | 6,6 (5,3–8,1) | 6,6 (5,4–7,6) | 0,6920 |
*Данные представлены как медиана (интерквартильный размах). **Тест Краскела – Уоллиса для сравнения непрерывных данных, χ2 для сравнения категориальных данных
Таблица 3. Параметры эмбриологического этапа у пациенток в группах сравнения
| Группа 1а, n = 36 | Группа 1б, n = 36 | Группа 2а, n = 36 | Группа 2б, n = 36 | р** | |
| Число фолликулов* | 10 (6–15) | 11 (7–14) | 8 (6–11) | 12 (8–14) | 0,0645 |
| Число ооцитов* | 9 (5–14) | 10 (6–12) | 7 (5–10) | 9 (8–13) | 0,0276 |
| Число ооцитов, метеафаза II* | 8 (4–10) | 7 (5–11) | 5 (3–8) | 6 (5–10) | 0,2933 |
| Доля зрелых ооцитов* | 0,80 (0,67–0,93) | 0,83 (0,71–1,0) | 0,83 (0,71–1,0) | 0,76 (0,55–0,95) | 0,2415 |
| Частота фертилизации* | 90,9 (77,5–100) | 100 (80,9–100) | 100 (83,8–100) | 100 (95–100) | 0,0973 |
| Число бластоцист* | 2 (1–5) | 3 (1–4) | 3 (1–4) | 3 (1–4) | 0,9527 |
| Число бластоцист отличного качества* | 2 (1–4) | 2 (1–4) | 2 (1–4) | 2 (1–4) | 0,8890 |
| Частота бластуляции* | 0,35 (0,25–0,50) | 0,41 (0,18–0,63) | 0,50 (0,35–0,71) | 0,50 (0,17–0,67) | 0,0903 |
| Наличие эмбрионов, пригодных для криоконсервации | 22 (61,1%) | 24 (66,7%) | 26 (72,2%) | 22 (61,1%) | 0,7181 |
*Данные представлены как медиана (интерквартильный размах). **Тест Краскела – Уоллиса для сравнения непрерывных данных, χ2 для сравнения категориальных данных
Таблица 4. Результаты циклов ВРТ в группах сравнения
| Группа 1а, n = 36 | Группа 1б, n = 36 | ОШ 1а/1б (95% ДИ) | Группа 2а, n = 36 | Группа 2б, n = 36 | ОШ 2а/2б (95% ДИ) | ОШ 1/2 (95% ДИ) | |
| Частота наступления беременности | 18 (50,0%) | 11 (30,6%) | 2,27 (0,78; 6,70) | 24 (66,7%) | 16 (44,4%) | 2,50 (0,87; 7,27) | 2,33 (1,14; 4,81) |
| Частота родов | 12 (33,3%) | 9 (25,0%) | 1,50 (0,48; 4,79) | 19 (52,8%) | 14 (38,9%) | 1,76 (0,62; 4,98) | 1,61 (0,77; 3,37) |
| Ʃ частота родов | 17 (47,2%) | 12 (33,3%) | 1,79 (0,62; 5,19) | 24 (66,7%) | 17 (47,2%) | 2,24 (0,78; 6,48) | 1,96 (0,96; 4,02) |
Рисунок. Результаты циклов ВРТ в группах сравнения
При сравнении групп 1 и 2 получено статистически значимое повышение частоты наступления беременности в группе 1 (ОШ 2,33, 95% ДИ 1,14; 4,81), однако различия при оценке частоты родов и кумулятивной частоты родов также не достигли статистической значимости. Полученные данные представлены в табл. 4
и на
рис
.
Было рассчитано число пациентов, лечению подвергаемых (ЧПЛП, англ. The Number Needed to Treat – NNT). В подгруппе пациенток с высоким уровнем АХВ (группа 1) абсолютное снижение риска (АСР) было рассчитано по формуле 18/36 – 11/36 = 0,5 – 0,306 = 0,194. ЧПЛП было рассчитано по формуле 1/0,194 = 5,2 = 5.
В подгруппе пациенток с низким уровнем АХВ (группа 2) АСР было рассчитано по формуле 24/12 – 16/20 = 0,667 – 0,444 = 0,223. ЧПЛП было рассчитано по формуле 1/0,223 = 4,5 = 5. В общей группе пациенток АСР было рассчитано по формуле 42/72 – 27/72 = 0,583 – 0,375 = 0,208. ЧПЛП было рассчитано по формуле 1/0,208 = 4,8 = 5.
Обсуждение
Многие пациентки, проходящие лечение бесплодия, принимают различные витамины и антиоксидантные препараты в надежде на улучшение фертильности. Для большинства пациенток подготовка к программам ВРТ сопряжена с большим эмоциональным стрессом. Проведение исследований, направленных на оценку эффективности антиоксидантных препаратов, является важной задачей, поскольку пациентам должны быть предоставлены объективные данные исследований, которые позволят им принимать решение о приеме данных препаратов. Сложность изучения данной проблемы обусловлена несколькими факторами. Во-первых, сложно учитывать антиоксиданты, поступающие с пищей, при этом особенности диеты и образа жизни также могут оказывать влияние на репродуктивное здоровье. Во-вторых, большинство из пероральных антиоксидантов зарегистрированы как биологически активные добавки, их реализация происходит не только через аптечные сети, но и в супермаркетах/спортивных клубах, что затрудняет их учет. Кроме того, нелекарственные средства не подвергаются всестороннему фармаконадзору, потому контроль дозировки активных компонентов и качества субстанции действующего вещества остается задачей производителя [9, 10]. В-третьих, в различных исследованиях изучали различные дозы и препараты, а в качестве конечных точек используют различные параметры (качество спермы, эмбриологические характеристики, результаты циклов ВРТ), которые, в свою очередь, могут зависеть от наличия множества факторов риска.
В проведенных ранее работах было показано негативное влияние АХВ на качество гамет и эмбрионов в циклах ВРТ [6, 11]. Основным механизмом воздействия факторов внешней среды на репродуктивное здоровье является индукция окислительного стресса, а основным механизмом антиоксидантов – нейтрализация свободных радикалов, а также активация синтеза ферментов антиоксидантной защиты [12]. Выбор препаратов для антиоксидантной терапии был обусловлен данными литературы [13–15].
Клинико-анамнестические характеристики не различались между группами. При оценке эмбриологического этапа наблюдали тенденцию к снижению общего числа ооцитов в экспериментальной группе, однако не было зарегистрировано различий в параметрах, отражающих качество ооцитов (число зрелых ооцитов, доля зрелых ооцитов в общей когорте). Также отмечена тенденция к снижению частоты фертилизации в группе пациенток с высоким уровнем АХВ, получавших антиоксидантную терапию (группа 1а). Аналогично частота бластуляции была несколько выше в группе пациенток с низким уровнем АХВ, хотя различия не достигли статистической значимости. Данные литературы о влиянии антиоксидантной терапии на эмбриологические параметры циклов ВРТ противоречивы. В части исследований не показано влияния препаратов на качество ооцитов и эмбрионов [12, 16]. Однако в других работах продемонстрировано повышение качества эмбрионов при назначении «средиземноморской диеты» [17] или пероральных антиоксидантов [18]. Авторы вышеуказанных исследований предполагают положительное влияние антиоксидантов на метаболические процессы в яичниках, однако подчеркивают необходимость проведения дальнейших исследований в данной области.
При оценке клинических результатов циклов ВРТ отмечена тенденция к повышению частоты наступления клинической беременности, частоты родов и кумулятивной частоты родов в подгруппах с использованием антиоксидантной терапии. Интересно отметить, что данные различия наблюдали в подгруппах как с высоким уровнем АХВ, так и низким уровнем АХВ, что предполагает участие дополнительных механизмов действия антиоксидантных препаратов.
Число пациентов, подвергаемых лечению, составило 5 как для общей группы пациентов, так и для подгрупп в зависимости от уровня АХВ.
Полученные результаты позволяют рекомендовать назначение антиоксидантной терапии для подготовки пациенток к программам ВРТ.
Сильной стороной данного исследования были рандомизированный дизайн, использование шкалы для оценки уровня АХВ в организме, применение одного протокола ВРТ для всех пациенток, оценка всех клинических исходов, включая кумулятивную частоту живорождения.
Слабой стороной был небольшой объем выборки, который не позволил получить статистически значимые различия в эффективности ВРТ у пациенток с различным уровнем АХВ.
Патофизиология окислительного стресса
Базисными механизмами патологии при любых критических состояниях, в том числе при операционной и травматической агрессии, являются свободно-радикальные процессы и изменения свойств биомембран клеток. Главная патологическая роль свободных радикалов заключается в том, что они активно взаимодействуют с молекулами, формирующими нейрональные и внутриклеточные мембраны. Повышается вязкость мембран, утрачивается их пластичность и функциональное состояние. Наряду с этим активируются гены, ответственные за программированную гибель клетки – апоптоз. Имеется прямая зависимость между накоплением продуктов ПОЛ и тяжестью поражения нервных клеток и других тканей.
Поскольку формирование тканевой гипоксии, ПОЛ, митохондриальная дисфункция признаны пусковым звеном развития типового патологического процесса, использование антигипоксантов и антиоксидантов патогенетически обосновано при операционной и травматической агрессии, воспалении и острой боли.
Восстановление кровотока в ранее ишемизированных тканях также представляет определенную опасность. Реперфузия обуславливает многократное повышение парциального давления кислорода с дальнейшим повышением свободно-радикальных процессов. При этом повреждается эндотелий капилляров, антикоагулянтная активность которых трансформируется в прокоагулянтную. Лейкоциты и тромбоциты вследствие увеличивающейся адгезии закупоривают капилляры. Усугубляется этот процесс и увеличением регидности эритроцитов, что резко усиливает нарушение оксигенации тканей, прежде всего мозга. Угнетается процессы фибринолиза крови, расширяется зона инфаркта мозга, усиливается отек мозга.
Основные патологические процессы, инициируемые чрезмерной активацией ПОЛ
I. Клеточно-тканевой уровень:
- ишемия;
- гипоксия;
- мембранопатия:
– нарушение проницаемости клеточной мембраны и мембран клеточных органелл;
– чрезмерное накопление свободных радикалов внутри клетки;
– выход лизосомальных ферментов внутрь клетки;
– накопление внутри клетки ионов Са++;
- апаптоз и некроз клеток;
- нарушение клеточной рецепции;
- энергетические и метаболические нарушения.
II. Органы
и системы:
- функциональные нарушения;
- органическая патология.
Конечно, в организме существует эндогенная антиоксидантная система (АОС), но при критических уровнях гипоксии и ПОЛ она несостоятельна и необходимо введение антиоксидантов извне.
Выводы
Детоксикационная терапия в рамках подготовки к циклам вспомогательной репродукции способствует повышению эффективности циклов ВРТ.
Полученные результаты позволяют рекомендовать назначение антиоксидантной терапии для подготовки пациенток к программам ВРТ.
Список литературы / References
- Thoma M.E., McLain A.C., Louis J.F., King R.B., Trumble A.C., Sundaram R., Buck Louis G.M. Prevalence of infertility in the United States as estimated by the current duration approach and a traditional constructed approach. Fertil Steril. 2013;99(5):1324-1331.e1. https://doi.org/10.1016/j.fertnstert.2012.11.037.
- Chandra A., Copen C.E., Stephen E.H. Infertility and impaired fecundity in the United States, 1982-2010: data from the National Survey of Family Growth. Natl Health Stat Report. 2013;(67):1-18. Available at: https://pubmed.ncbi.nlm.nih.gov/24988820
- Pizzol D., Foresta C., Garolla A., Demurtas J., Trott M., Bertoldo A., Smith L. Pollutants and sperm quality: a systematic review and meta-analysis. Environ Sci Pollut Res Int. 2021;28(4):4095-4103. https://doi.org/10.1007/s11356-020-11589-z.
- Fichman V., Costa R.S.S.D., Miglioli T.C., Marinheiro L.P.F. Association of obesity and anovulatory infertility. Einstein (Sao Paulo). 2020;18:eAO5150. https://doi.org/10.31744/einstein_journal/2020AO5150.
- Carvalho L.V.B., Hacon S.S., Vega C.M., Vieira J.A., Larentis A.L., Mattos R.C.O.C. et al. Oxidative Stress Levels Induced by Mercury Exposure in Amazon Juvenile Populations in Brazil. Int J Environ Res Public Health. 2019;16(15):2682. https://doi.org/10.3390/ijerph16152682.
- Сыркашева А.Г., Франкевич В.Е., Долгушина Н.В. Ассоциация между уровнем тяжелых металлов в организме женщин с бесплодием и исходами программ вспомогательных репродуктивных технологий. Акушерство и гинекология. 2020;(11):124-130. https://doi.org/10.18565/aig.2020.11.124-130.
- Сыркашева А.Г., Долгушина Н.В., Макарова Н.П., Ковальская Е.В., Агаршева М.А. Исходы программ вспомогательных репродуктивных технологий у пациенток с дисморфизмами ооцитов. Акушерство и гинекология. 2015;(7):56-62. Режим доступа: https://aig-journal.ru/articles/Ishody-programm-vspomogatelnyh-reproduktivnyh-tehnologii-upacientok-s-dismorfizmami-oocitov.html.
- Gardner D., Schoolcraft W.B. Culture and transfer of human blastocysts. Curr Opin Obs Gynecol. 1999;11(3):307-311. https://doi.org/10.1097/00001703-199906000-00013.
- Калугина А.С., Беспалова А.Н., Ковалева И.В., Баклейчева М.О. Эффективность применения витаминно-минерального комплекса во время беременности. Фарматека. 2019;26(6):74-78. https://doi.org/10.18565/pharmateca.2019.6.73-78.
- Brough L., Rees G.A., Crawford M.A., Morton R.H., Dorman E.K. Effect of multiple-micronutrient supplementation on maternal nutrient status, infant birth weight and gestational age at birth in a low-income, multiethnic population. Br J Nutr. 2010;104(3):437-445. https://doi.org/10.1017/S0007114510000747.
- Сыркашева А.Г., Киндышева С.В., Стародубцева Н.Л., Франкевич В.Е., Долгушина Н.В. Влияние бисфенола А на исходы программ вспомогательных репродуктивных технологий у пациентов с бесплодием. Гинекология. 2021;23(2):161-166. Available at: https://omnidoctor.ru/library/izdaniya-dlya-vrachey/ginekologiya/gn2021/gn2021_23_2/vliyaniebisfenola-a-na-iskhody-programm-vspomogatelnykh-reproduktivnykhtekhnologiy-u-patsientov
- Zarezadeh R., Mehdizadeh A., Leroy J.L.M.R., Nouri M., Fayezi S., Darabi M. Action mechanisms of n-3 polyunsaturated fatty acids on the oocyte maturation and developmental competence: Potential advantages and disadvantages. J Cell Physiol. 2019;234(2):1016-1029. https://doi.org/10.1002/jcp.27101.
- Ohsawa I., Ishikawa M., Takahashi K., Watanabe M., Nishimaki K., Yamagata K. et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals. Nat Med. 2007;13(6):688-694. https://doi.org/10.1038/nm1577.
- Falsig A.-M.L., Gleerup C.S., Knudsen U.B. The influence of omega-3 fatty acids on semen quality markers: a systematic PRISMA review. Andrology. 2019;7(6):794-803. https://doi.org/10.1111/andr.12649.
- Chiu Y.-H., Karmon A.E., Gaskins A.J., Arvizu M., Williams P.L., Souter I. et al. Serum omega-3 fatty acids and treatment outcomes among women undergoing assisted reproduction. Hum Reprod. 2018;33(1):156-165. https://doi.org/10.1093/humrep/dex335.
- Lass A., Belluzzi A. Omega-3 polyunsaturated fatty acids and IVF treatment. Reprod Biomed Online. 2019;38(1):95-99. https://doi.org/10.1016/j.rbmo.2018.10.008.
- Kermack A.J., Lowen P., Wellstead S.J., Fisk H.L., Montag M., Cheong Y. et al. Effect of a 6-week “Mediterranean” dietary intervention on in vitro human embryo development: the Preconception Dietary Supplements in Assisted Reproduction double-blinded randomized controlled trial. Fertil Steril. 2020;113(2):260-269. https://doi.org/10.1016/j.fertnstert.2019.09.041.
- Xu Y., Nisenblat V., Lu C., Li R., Qiao J., Zhen X., Wang S. Pretreatment with coenzyme Q10 improves ovarian response and embryo quality in lowprognosis young women with decreased ovarian reserve: a randomized controlled trial. Reprod Biol Endocrinol. 2018;6(1):29. https://doi.org/10.1186/s12958-018-0343-0.


![Рис. 1. Исследование ACCOMPLISH: влияние комбинации иАПФ* амлодипин и иАПФ гидрохлоротиазид на риск событий первичной конечной точки (ССС) [14]](https://expert35.ru/wp-content/uploads/ris-1-issledovanie-accomplish-vliyanie-kombinacii-iapf-amlodipin-i-iapf-330x140.jpg)