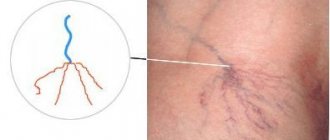
Причины варикоза пищевода
Заболевание развивается на фоне повышенного давления в портальной вене (она же воротная), но его возникновению могут способствовать другие патологии (гипертоническая болезнь, врожденные аномалии и так далее). Варикоз пищевода, причины которого кроются в патологических изменениях воротной вены, нередко начинает прогрессировать при ранее диагностированных тяжелых заболеваниях печени или поджелудочной железы – циррозе, опухолях, недостаточности. Болезнь нередко развивается и на фоне тяжелых заболеваний щитовидной железы, в таком случае речь будет идти о патологических нарушениях со стороны полой вены.
По статистике, варикоз пищевода чаще диагностируется у мужчин в возрасте 50 лет и старше.
Цирроз печени (ЦП) — это диффузный процесс, характеризующийся фиброзом и образованием узлов, развивающихся вследствие некроза гепатоцитов [8]. Среди причин заболевания первое место занимают алкогольные циррозы (около 40%), второе — вирусные заболевания [1].
Помимо клинических проявлений основного заболевания, при ЦП наблюдаются два ведущих синдрома: печеночно-клеточная недостаточность и портальная гипертензия. Тяжесть этих синдромов определяет прогноз и тактику лечения [4, 6]. Основными причинами смерти больных с декомпенсированным ЦП являются кровотечения из варикозно-расширенных вен (ВРВ) пищевода и желудка, энцефалопатия, инфекционные осложнения (спонтанный бактериальный перитонит) и гепаторенальный синдром. Необходимо подчеркнуть, что ЦП — это мультидисциплинарная проблема. Лечение проявлений и осложнений ЦП находится в компетенции врачей нескольких специальностей — терапевтов, гастроэнтерологов, хирургов, реаниматологов. От согласованности и преемственности их действий зависит жизнь больного. Действительно, при возникновении кровотечения из ВРВ пищевода и желудка важна не только хирургическая тактика, но и то, как быстро больной будет госпитализирован в реанимационное отделение и начата интенсивная терапия.
В основе кровотечений из ВРВ пищевода и желудка лежит портальная гипертензия, под которой понимают синдром повышенного давления в бассейне воротной вены, связанный с нарушением кровотока в портальных сосудах, печеночных венах и нижней полой вене.
Система кровообращения в печени имеет свои особенности. Кровь в печень поступает из печеночной артерии (͌30%) и воротной вены (͌70%), суммарный кровоток составляет около 1500 мл/мин. В физиологических условиях практически вся портальная кровь оттекает по печеночным венам, однако при ЦП этот показатель может снижаться до 20%. Воротная вена связана многочисленными анастомозами с полыми венами (портокавальные анастомозы), к которым относят анастомозы с венами пищевода и венами желудка, прямой кишки, околопупочными венами и венами передней брюшной стенки. Анастомозы играют важную роль в развитии коллатерального кровообращения при нарушениях оттока в системе воротной вены.
Патогенез портальной гипертензии связан с повышением гидромеханического сопротивления соответствующего участка сосудистого русла. В норме давление в портальной вене составляет около 3-7 мм рт.ст., портальную гипертензию диагностируют при давлении, превышающем 12 мм рт.ст. Повышение сопротивления портальному кровотоку приводит к образованию портосистемных коллатералей. По ним отводится часть портального кровотока от печени, что способствует уменьшению портальной гипертензии, но не полному ее устранению.
Давление в портальной системе можно выразить следующим уравнением: Р=Q·R, из которого следует, что давление крови в портальной системе (Р) равно произведению объема кровотока (Q) на сопротивление (R), поэтому повышение давления может произойти как за счет увеличения объема кровотока, так и за счет сопротивления. При пропорциональном уменьшении одного фактора и увеличении другого давление не меняется [7]. При ЦП давление в портальной системе возрастает за счет как повышения сосудистого сопротивления, так и увеличения объема портальной крови вследствие расширения сосудов внутренних органов на фоне гипердинамического синдрома. Повышение сосудистого сопротивления обусловлено двумя факторами — развитием соединительной ткани и перестройкой кровотока в печени (механический фактор) и обратимым сокращением гладкомышечных волокон стенки сосудов под влиянием нервной и гуморальной регуляции (динамический фактор).
Существующая классификация портальной гипертензии основана на данных о локализации блокады портального кровотока. В соответствии с этим выделяют следующие формы портальной гипертензии: надпеченочную, внутрипеченочную и подпеченочную.
Надпеченочная форма портальной гипертензии связана с блокадой печеночного оттока. Она чаще всего возникает при синдроме Бадда-Киари (тромбоз печеночных вен). Исходом этого состояния обычно является ЦП.
Подпеченочная форма портальной гипертензии обусловлена блокадой портального притока. Выделяют первичную подпеченочную портальную гипертензию, возникающую при тромбозе воротной вены, и вторичную, которая является следствием вовлечения сосудов воротной вены в окклюзионный процесс при новообразованиях или воспалении поджелудочной железы. Для этих процессов типично развитие портокавальных и порто-портальных анастомозов.
Наиболее часто развивается внутрипеченочная портальная гипертензия, возникающая при цирротической трансформации печени. При ЦП происходит существенная перестройка клеточной и сосудистой архитектоники печени. Узловая регенерация печени нарушает нормальную дренажную функцию ветвей печеночных вен. Дополнительно к указанному в результате замещения паренхимы печени соединительной тканью происходит редукция внутрипеченочных разветвлений воротной вены, приводящая к повышению давления в системе воротной вены и активному функционированию портокавальных анастомозов. При нарушении нормальной структуры печени существенные изменения претерпевает и синусоидальная сеть печеночных долек. При этом происходит формирование анастомозов между ветвями воротной вены, печеночной артерии и ветвями печеночных вен, т.е. развиваются прямые портопеченочные шунты. Таким образом, коллатеральное кровообращение при ЦП осуществляется не только по внутрипеченочным шунтам, но и по внепеченочным портокавальным анастомозам. Значительная часть крови при этом проходит через печень, минуя активную паренхиму. Редукция эффективного печеночного кровотока может достигать 50%. Кровообращение в обход активной паренхимы печени значительно ухудшает метаболизм печеночных клеток.
Необходимо указать, что клинические проявления синдрома портальной гипертензии разнообразны, но чаще всего регистрируют ВРВ пищевода и желудка, асцит, печеночную энцефалопатию и гепаторенальный синдром. Для клиницистов очень важным диагностическим критерием является возникновение признаков портальной гипертензии в виде кровотечений из ВРВ пищевода и желудка. При повышении давления постепенно происходит варикозная трансформация вен и развивается васкулопатия. На фоне прогрессирующего ухудшения условий оттока крови из бассейна воротной вены возникают портальные гипертонические кризы, которые служат пусковым механизмом кровотечений из ВРВ пищевода и желудка.
Риск кровотечений зависит от уровня портального давления, порог 12 мм рт.ст. обычно является критическим для возникновения кровотечений, именно на этот показатель ориентируются при лечении портальной гипертензии. Вероятность разрыва венозной стенки коррелирует с ее напряжением и описывается по закону Лапласа, в соответствии с которым напряжение стенки (Т) определяется как градиент между внутрисосудистым (Pi) и внесосудистым (Ре) давлением (Pi-Ре) и отношением радиуса сосуда (r) к толщине сосудистой стенки (w):
Т=(Pi-Ре)·r/w.
Эндоскопическая оценка риска кровотечений зависит от наличия воспалительных изменений слизистой пищевода и желудка, размеров поражения вен и наличия признаков высокого напряжения их стенки: вишнево-красные пятна и кровяные кисты (англ. — cherry red spots, varices on top of the varices) [1, 8].
На момент установления диагноза ЦП у 50% больных имеются ВРВ пищевода и желудка. Риск формирования ВРВ выше у больных с алкогольным ЦП. В первый год кровотечения из ВРВ возникают у 12% больных. Летальность при первом эпизоде кровотечения составляет 20-25%. Второй эпизод кровотечения развивается у 60% пациентов, вероятность смертельного исхода при этом составляет 20-35% [10, 12].
При возникновении кровотечения из ВРВ пищевода и желудка проводят интенсивную терапию, направленную на коррекцию гемодинамических нарушений, связанных с гиповолемией [4]. В отделении реанимации катетеризируют центральную вену, проводят мониторинг витальных показателей, гемоглобина, почасового диуреза, креатинина, мочевины, электролитов, коагулограммы. Первым этапом лечебных мероприятий является инфузионная терапия, направленная на восполнение объема циркулирующей крови, которая включает переливание растворов коллоидов и кристаллоидов, эритроцитной массы, проведение гемостатической терапии, применение свежезамороженной плазмы и тромбоцитной массы при наличии нарушений гемостаза. Устанавливают назогастральный зонд для контроля возникновения кровотечения и промывания желудка. Всем больным с подозрением на кровотечение из ВРВ проводят экстренное эндоскопическое исследование пищевода и желудка.
Следует заметить, что кровотечение из ВРВ пищевода и желудка при ЦП крайне неблагоприятно влияет на функцию гепатоцитов, поскольку обусловливает снижение доставки кислорода к клеткам вследствие анемии. Одновременно увеличивается нагрузка на печень из-за нарастания интоксикации при распаде крови в кишечнике.
Предложено много различных способов остановки кровотечения из ВРВ пищевода и желудка, в основе которых по существу лежат два принципа: 1) снижение давления в портальной системе медикаментозно или с помощью операций шунтирования, 2) проведение облитерации варикозных узлов и баллонная тампонада. Исходя из этого, способы достижения гемостаза при кровотечении из ВРВ можно разделить на 4 группы: фармакологические, эндоскопические, баллонная тампонада и хирургические. Вместе с тем все методы остановки кровотечения не способны влиять на течение основного заболевания, поскольку воздействуют на следствие, а не на причину. Остановка кровотечения позволяет лишь пережить этот эпизод больным ЦП. В дальнейшем они нередко умирают от других осложнений. На сегодня единственно возможным кардинальным решением рассматриваемой проблемы является трансплантация печени.
С целью неспецифической профилактики кровотечений из ВРВ пищевода и желудка больным ЦП следует отказаться от приема аспирина и нестероидных противовоспалительных лекарственных средств. Рекомендуется плановый прием блокаторов Н2-рецепторов и ингибиторов протонной помпы.
Для первичной профилактики кровотечений из ВРВ у пациентов с портальной гипертензией используют неселективные β-блокаторы (пропранолол, надолол, тимолол) [5]. Механизм снижения давления в воротной вене при приеме этих препаратов связан с констрикцией сосудов внутренних органов и в меньшей мере со снижением сердечного выброса. Показаниями к назначению β-блокаторов служат значительные размеры ВРВ и наличие красных пятен на узлах, выявляемых при эндоскопическом исследовании. Во время лечения давление в воротной вене желательно поддерживать на уровне менее 12 мм рт.ст. Перспективным методом оценки проводимой терапии является определение градиента внутрипеченочного венозного давления, однако этот метод относится к числу инвазивных и не может широко использоваться в лечебных учреждениях. Косвенным подтверждением эффективности β-блокаторов может служить снижение частоты сердечных сокращений в покое на 25% (но не менее 55 ударов в 1 мин без сопутствующей артериальной гипертензии). Установлено, что неселективные β-блокаторы примерно на 45% уменьшают риск кровотечения из ВРВ пищевода и желудка, данные об их влиянии на показатель смертности противоречивы [2, 20].
Для первичной профилактики кровотечений при ВРВ среднего и большого размеров также предпринимались попытки эндоскопического лигирования вен. Однако было показано, что эффективность назначения β-блокаторов и лигирования не различалась [18], поэтому назначение β-блокаторов имеет преимущества в силу экономической составляющей и сложности методики лигирования.
При возникновении кровотечений из ВРВ широко используют вазоактивные препараты, с помощью которых достигают снижения давления в воротной вене и уменьшения натяжения варикозно-расширенной стенки сосуда. В соответствии с механизмом снижения портального давления их можно разделить на две группы. К первой группе относятся вазодилататоры, влияющие на динамический компонент портальной резистентности (нитраты — изосорбит 5-мононитрат). Однако эти препараты редко используют в виде монотерапии (в том числе из-за гипотензивного эффекта), обычно их применяют в комбинации с вазоконстрикторами. Ко второй группе относятся вазоконстрикторы, которые снижают портальное давление за счет спланхнической вазоконстрикции и соответственно уменьшения портального притока крови.
К прямым вазоконстрикторам относятся вазопрессин и его синтетический аналог терлипрессин. Эти препараты действуют непосредственно на гладкомышечные клетки кровеносных сосудов. Механизм действия непрямых вазоконстрикторов — соматостатина и его синтетического аналога октреотида объясняется ингибированием активности эндогенных вазодилататоров (в частности, глюкагона).
Вазопрессин был одним из первых препаратов, который использовался для снижения портального давления и остановки кровотечения из ВРВ. Он вызывает спазм артериол внутренних органов и уменьшение портального кровотока. Однако от применения вазопрессина отказались из-за большого количества побочных эффектов, присущих препарату, и прежде всего из-за возможности вызывать ишемические изменения в миокарде.
В настоящий момент в клинической практике широко используется терлипрессин (N-триглицил-8-лизин-вазопрессин) — синтетический аналог гормона задней доли гипофиза вазопрессина. От вазопрессина терлипрессин отличается тремя дополнительными глициновыми остатками, соединенными с N-концом молекулы, и замещением в восьмой позиции аргинина лизином. Фармакологическое действие терлипрессина проявляется сосудосуживающим эффектом артериол, венул и вен висцеральных органов, что приводит к уменьшению портального кровотока и снижению портального давления. Изменение химической структуры вазопрессина способствовало увеличению длительности действия препарата и уменьшению побочных эффектов. Это позволяет вводить его болюсно, а не в виде длительной внутривенной инфузии.
Эффективность терлипрессина была доказана в многочисленных клинических исследованиях. Установлено, что однократное введение препарата в дозе как 1 мг, так и 2 мг приводит к снижению давления в портальной вене в течение 4 ч. Кроме того, после остановки кровотечения назначение терлипрессина по 1 мг каждые 4 ч в течение 5 дней достоверно снижало риск повторного кровотечения [14].
На основании метаанализа 20 рандомизированных исследований, посвященных эффективности и безопасности использования терлипрессина у больных с кровотечениями из ВРВ пищевода и желудка, был сделан вывод, что использование препарата снижает общую смертность на 34% по сравнению с плацебо. Количество побочных эффектов минимально, и терлипрессин переносится так же хорошо, как октреотид и соматостатин [19].
При сравнении терлипрессина с соматостатином у больных ЦП выявили бо`льшую эффективность первого препарата. При назначении терлипрессина остановку кровотечения зарегистрировали у 91% пациентов, а в группе соматостатина — у 81% [25]. В другом исследовании для остановки кровотечения из ВРВ у больных ЦП использовали стандартные дозы терлипрессина. Для достижения сопоставимых результатов в контрольной группе потребовались повышенные дозы соматостатина [26].
В работах, посвященных сравнительному изучению влияния терлипрессина и октреотида на величину портальной гипертензии, было установлено, что терлипрессин достоверно и длительно снижал давление в варикозных узлах. Вместе с тем эффект октреотида был кратковремен, повторное назначение октреотида не продлевало и не поддерживало его эффекты [15, 21].
Анализ современных методов остановки кровотечения из ВРВ позволил J. Bosch и соавт. [11] сделать вывод, что терлипрессин является препаратом выбора, так как это единственное лекарственное средство, которое позволяет повысить выживаемость при этом патологическом состоянии.
В современной клинической практике довольно часто для экстренного лечения кровотечения из ВРВ пищевода и желудка используют эндоскопическую склеротерапию. Она может быть выполнена сразу во время первой диагностической эндоскопии или отложена до момента остановки кровотечения консервативными методами. Во время процедуры через канал эндоскопа проводят иглу, через которую склерозирующий раствор вводят или в варикозные узлы, или в непосредственной близости от них. Это ведет к образованию рубцовой ткани и тромбозу сосудов. Обычно процедуру выполняют несколько раз, достигая полной облитерации всех имеющихся у пациента узлов, что занимает от нескольких дней до нескольких недель. Эффективность данного метода составляет от 70 до 90% [23]. Вместе с тем эндоскопическая склеротерапия с целью остановки кровотечений из ВРВ пищевода и желудка может сопровождаться рядом осложнений. Описано преходящее нарушение моторики пищевода. Более серьезным осложнением является стойкая дисфагия, связанная с формированием рубцовых структур, риск развития которых зависит от числа инъекций и количества введенного склерозанта [22]. Также после склеротерапии возможно возникновение язв слизистой пищевода, что может привести как к кровотечению, так и к некрозу стенки с последующей перфорацией и развитием медиастинита [9].
В последнее время стали применять методику лигирования ВРВ пищевода, предложенную в 1986 г. G. Stiegmann. Она оказалась более эффективной при рецидивах кровотечения, чем склеротерапия [24]. Для осуществления этой методики необходим эндоскоп со специальным лигирующим устройством. При выполнении процедуры варикозно-расширенную вену аспирируют в лигирующее устройство и надевают на нее эластичное кольцо. Метод прост в исполнении и дает меньше осложнений, чем склеротерапия.
Временная остановка кровотечения может быть достигнута при баллонной тампонаде с помощью зонда-обтуратора Сенгстакена-Блейкмора или саморасширяющихся пищеводных стентов. Применение баллонной тампонады, по современным данным, считается оправданным в случае необходимости транспортировки больного с кровотечением или при невозможности использования других методов лечения, в частности при массивном кровотечении, когда проведение склерозирующей терапии затруднено из-за плохой видимости. Суммарное время нахождения зонда Сенгстакена-Блейкмора в пищеводе не должно превышать 24 ч, поскольку в дальнейшем его пребывание может привести к изъязвлению слизистой нижних отделов пищевода.
При выборе тактики лечения больных с кровотечениями из ВРВ пищевода и желудка предпочтение отдают использованию терлипрессина. В Европе выработана стандартная схема ведения таких пациентов [13]. В России такая возможность появилась в 2012 г. при регистрации препарата реместипа (терлипрессин). Общепринятые методы интенсивной терапии, включающие инфузионно-трансфузионную терапию и постоянный мониторинг жизненно важных функций организма, дополняют назначением терлипрессина. Препарат вводят внутривенно в дозе 1 мг при установлении диагноза кровотечения из ВРВ пищевода и желудка. Повторные дозы назначают каждые 4 ч. На 2-е сутки начинают нутритивную поддержку жидкими питательными смесями с последующим переходом на бессолевую диету. Параллельно для профилактики инфекционных осложнений назначают per os 400 мг норфлоксацина каждые 12 ч. Терапия терлипрессином обычно длится 2-5 сут. В это же время выполняют лигирование ВРВ, хотя при отсутствии технической возможности допускается эндоскопическая склеротерапия [16]. В дальнейшем больного выписывают с рекомендациями принимать β-блокаторы и последующего планового проведения курсов лигирования ВРВ.
При неэффективности медикаментозной терапии и эндоскопической остановки и продолжающемся кровотечении показано оперативное вмешательство. Часто хороший эффект дает гастротомия с прошиванием ВРВ пищевода и желудка. Выполнение хирургического вмешательства не исключает рецидивов кровотечения. Кроме того, при печеночно-клеточной недостаточности наблюдается снижение синтеза факторов свертывания, что ухудшает результаты операции, несмотря на переливание плазмы.
Уменьшение портальной гипертензии может быть достигнуто путем портокавального шунтирования. В настоящее время распространены три основных типа таких операций: тотальное, селективное и парциальное шунтирование [1, 17].
Тотальное шунтирование осуществляют путем наложения сосудистых анастомозов большого диаметра с воротной, селезеночной или верхней брыжеечной веной. При этом полностью устраняется портальная гипертензия и угроза кровотечения из ВРВ пищевода и желудка. Существенным недостатком операции является возникновение в послеоперационном периоде выраженной печеночной энцефалопатии.
Селективное спленоренальное шунтирование основано на формировании дистального спленоренального анастомоза. Суть операции заключается в избирательном шунтировании селезеночно-желудочного бассейна при сохранении редуцированного кровотока по воротной вене. В результате значительно снижается риск развития возможных кровотечений при портальной гипертензии. Качество жизни пациентов после выполнения рассмотренной операции значительно выше, чем при тотальном шунтировании.
Парциальное портокавальное шунтирование осуществляют путем наложения анастомоза малого диаметра (8-10 мм) бок в бок с любым магистральным сосудом портальной системы. При этом, с одной стороны, обеспечивается декомпрессия портальной системы, достаточная для профилактики кровотечений из ВРВ пищевода и желудка, с другой — сохраняется редуцированный кровоток в воротной вене.
Относительно новым методом остановки кровотечения является трансюгулярное интрапеченочное портосистемное шунтирование. В основе метода лежит установка стента между ветвями печеночной и портальной вен, что приводит к частичному сбросу крови в системный кровоток и снижению портального давления [3]. Диаметр стента подбирают таким образом, чтобы градиент портального давления оказался ниже 12 мм рт.ст. К недостаткам метода стоит отнести развитие осложнений в виде стеноза и дислокации стентов.
Рецидивирующее кровотечение из ВРВ и терминальная стадия ЦП являются показаниями к трансплантации печени. Однако ранее наложенные портосистемные анастомозы затрудняют трансплантацию, особенно если манипуляции проводили на воротах печени.
Таким образом, кровотечение из ВРВ пищевода и желудка является одним из самых прогностически неблагоприятных осложнений ЦП и портальной гипертензии. Методы остановки кровотечения включают медикаментозную вазоактивную терапию (терлипрессин), направленную на снижение портального давления, и эндоскопическое воздействие (склерозирование и лигирование ВРВ). При неэффективности консервативной терапии выполняют трансюгулярное интрапеченочное портосистемное шунтирование или портокавальное шунтирование открытым доступом. Больные с ЦП и кровотечением из ВРВ являются кандидатами на пересадку печени. Использование терлипрессина для остановки кровотечения из ВРВ у больных ЦП позволяет снизить число рецидивов кровотечения, количество гемотрансфузий и подготовить больных к плановым хирургическим вмешательствам по поводу портальной гипертензии.
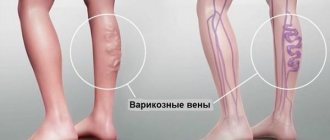
Варикоз пищевода: симптомы
В зависимости от степени развития выделяют следующие признаки:
- Первая степень. Диаметр вен увеличен не более чем на 3 мм, возможно формирование единичных узлов. Диагностировать заболевание возможно только эндоскопическим методом, клинические признаки отсутствуют.
- Вторая степень. Достаточно опасный период варикоза пищевода – симптомы отсутствуют (даже слизистая органа пока остается без изменений), но одновременно с этим контур вен уже становится нечетким, при рентген-диагностике обнаруживаются утолщения на венах (предвестники узелков). Уже на этом этапе возможно кровотечение, которое при отсутствии немедленной медицинской помощи часто приводит к летальному исходу.
- Третья и четвертая степени варикоза пищевода характеризуются выраженной симптоматикой – больного часто беспокоит изжога, в области грудины возникают боли, возможна одышка, причем, не только при физической активности, но и в покое. Нередко заболевание диагностируется только на поздних стадиях своего развития, когда появляются первые кровотечения, кровь при этом выделяется непосредственно из пищевода или обнаруживается в рвотных массах.
Ваше здоровье — в руках профессионалов!
Креймер Вадим Дмитриевич
- д.м.н., заведующий Клиникой гастроэнтерологии и пищеварения, врач-гастроэнтеролог, эндоскопист.
- Профессор Европейской Ассоциации гастроинтестинальной эндоскопии.
- Является автором и соавтором более 100 научных работ, в том числе 3х монографий.
- За заслуги в области медицины награжден орденом «LABORE ET SCIENTIA» (трудом и знанием) Европейского научно-промышленного консорциума.
Покровский Юрий Анатольевич
- к.м.н., врач-гастроэнтеролог, эндоскопист.
- Высокопрофессиональный врач, один из немногих гастроэнтерологов России, который сам делает своим пациентом все обследования, включая гастро- и колоноскопию.
- Доктор Покровский – сертифицированный онколог и гастроэнтеролог, долгое время занимался проблемами опухолей желудочно-кишечного тракта.
Лечение
Лечение варикоза вен пищевода начинается с выяснения истинных причин развития заболевания. Если диагностируется патология печени, щитовидной или поджелудочной железы, то обязательно проводится ее лечение – нужно ликвидировать провоцирующий фактор или ослабить его влияние. Из лекарственных препаратов назначают витаминные комплексы, антациды и вяжущие средства. Если диагностировано кровотечение, то всегда есть риск повторного его развития. В таком случае назначают:
- переливание крови;
- кровоостанавливающие препараты;
- введение специального зонда, которым можно сдавить сосуды.
Варикоз пищевода, кровотечение при котором наблюдается слишком часто, требует оперативного метода лечения.
Хирургическое вмешательство проводится также при отсутствии эффекта от терапевтического лечения. Купируется ли в этом случае варикоз пищевода? Прогноз более благоприятный – выживаемость больных увеличивается в 3 раза. После любого лечения нужно соблюдать диетические рекомендации врачей, регулярно проходить обследования и исключать чрезмерные физические нагрузки.
Более подробно о том, что такое варикоз пищевода и к какому врачу следует обращаться, можно узнать на страницах нашего сайта Добробут.ком.
Диагностика
Диагноз можно заподозрить, но нельзя подтвердить без эзофагогастродуоденоскопии. Это практически единственный способ установить связь кровотечения с варикозом пищевода, часто одновременно обнаруживают варикозное расширение вен желудка.
По рентгенограмме можно выявить воспаление, опухоли, спастическое сокращение с нарушением проходимости
Процедура позволяет установить степень деформации вен, стадию заболевания, визуально определить состояние сосудистых стенок, прогнозировать разрыв. Проводить исследование во время кровотечения практически невозможно.
В плановом порядке назначается контрастная рентгенография пищевода, перед снимком пациенту дают выпить смесь бария. По серии рентгенограмм отслеживают движение контраста и растекание его в просвете пищевода.
Лабораторным путем:
- необходимо установить наличие анемии по содержанию эритроцитов, тромбоцитов, цветному показателю;
- при остром кровотечении подсчитывают гематокрит;
- обязательно делают анализ показателей свертываемости;
- определяют функцию печени по ферментным тестам, уровню белка, глюкозы, билирубина, отклонения результатов дают возможность заподозрить влияние печеночной патологии на изменение в венозной системе пищевода;
- при наличии признаков кровотечения определяют группу крови и резус-фактор на случай необходимого переливания крови.
Даже минимальное выделение крови с калом подтверждается реакцией Грегерсена на скрытую кровь.
Прогноз при циррозе печени
Для заболевания сосудов ЖКТ характерна высокая смертность. При циррозе она достигает 50%. Летальность зависит не от характера кровотечения, а от тяжести поражения органа.
В 80% случаях кровоизлияние происходит самостоятельно, поэтому вероятность выздоровления есть у тех больных, которые отличаются хорошим состоянием печени. Но 75% пациентов в течение первых двух лет подвержены рецидиву.
Чтобы улучшить состояние при ВРВ необходимо регулярно проходить медикаментозную поддержку и эндоскопическое лечение.
Хоть ВРВП не поддается лечению, больной может прожить десятилетия, если будет поддерживать свое состояние своевременными обследованиями, скорректирует питание и режим сна и отдыха. Будьте здоровы!