Кратко о методе лечения
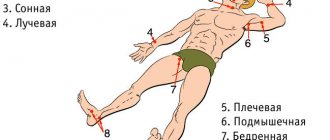
Бедренно-подколенное шунтирование — открытая хирургическая операция по созданию обходного пути для кровотока при закупорке бедренной артерии на ноге. Операция показана при критической ишемии и угрозе потери конечности, но иногда и при лимитирующей перемежающейся хромоте, если пациенту для повседневной жизни недостаточно проходимого расстояния. Операция заключается в соединении шунта (искусственного сосуда) с общей бедренной артерией в паховой области и проведении его к проходимому участку подколенной артерии выше или ниже коленного сустава. Бедренно-подколенное шунтирование может проводиться с помощью искусственного протеза или с помощью собственной вены пациента. Операция продолжается обычно около 60 минут, проводится под эпидуральной или спинальной анестезией. Для операции требуется как минимум два хирургических разреза. Эффективность операции высокая. При использовании ее по показаниям проходимость шунта составляет 80% в течение 5 лет.
Лечение критической ишемии нижних конечностей (КИНК) является одним из сложнейших вопросов современной сосудистой хирургии. Частота встречаемости КИНК достигает 500—1000 случаев на 1 млн населения в год [29].
Для лечения больного с КИНК врач выбирает один из двух вариантов: ампутация пораженной конечности или попытка восстановления кровотока по ней. В настоящее время от 70 до 90% ампутаций в мире проводят по поводу КИНК, в России этот показатель еще выше [8, 9, 22]. При ампутации ноги резко снижается качество жизни, уменьшается ее продолжительность [32, 33, 41]. С хирургической точки зрения, ампутация у больных данной категории не может являться операцией выбора. При ампутации ниже коленного сустава развивается до 60% гнойно-некротических осложнений [38], повторная ампутация в данном случае требуется еще у 15% больных [29], а летальность при ее выполнении превышает 30% [12]. Рана после ампутации выше колена заживает лучше, но процедура ухудшает возможность реабилитации больного.
Важнейшей задачей для сохранения конечности является поддержание кровотока на минимально необходимом уровне. Это достигается тремя путями [26, 28, 31, 45]:
— прямая реваскуляризация (шунтирующие операции или чрескожная ангиопластика магистральных артерий (ЧКА МА)
;
— непрямая реваскуляризация: денервирующие вмешательства, стимуляция неоангиогенеза хирургическая (перфорирующая остеотрепанация, пересадка большого сальника на конечность) и терапевтическая (введение мононуклеаров костного мозга, генных препаратов, тромбоцитарной взвеси);
— медикаментозное лечение.
Единой тактики для лечения таких больных до сих пор не определено, каждый из авторов старается показать наиболее оптимальный с его точки зрения метод как «панацею».
Общепризнано, что наиболее эффективным вариантом реконструкции является прямая реваскуляризация конечности. Однако при выполнении вмешательств врач сталкивается с рядом вопросов об экономической эффективности процедуры, отдаленных результатах и наибольшей безопасности для больного.
Большая часть больных с КИНК имеют тяжелые сопутствующие заболевания, которые увеличивают летальность в ближайшем послеоперационном периоде [21]. Лучший вариант лечения должен быть: малоинвазивным, безопасным, простым в исполнении и доступным для использования.
КИНК является жизнеугрожающим состоянием, при котором основной целью является сохранение конечности и жизни больного. С нашей точки зрения, лечение КИНК можно и нужно разделить на два этапа:
— 1-й этап: непосредственно спасение конечности
наименее инвазивным методом с последующей стабилизацией клинического состояния. Этот этап должен обеспечивать компенсацию кровообращения в ноге. Оптимальным условием считаем наличие магистрального кровотока в течение 3 мес после реконструкции. Этого срока достаточно для проведения тщательного обследования и коррекции сопутствующих заболеваний, например, выполнения реваскуляризации миокарда и/или реконструкции брахицефальных артерий (БЦА), а также реабилитации после этих вмешательств;
— 2-й этап: хирургическая реконструкция, направленная на поддержание функции конечности «неограниченно» длительный срок
.
Исходя из сказанного выше, мы будем анализировать варианты лечения в 2 клинических ситуациях: поражение на уровне бедренно-подколенного сегмента и на уровне подколенно-берцового сегмента. Аортобедренный сегмент из данного обзора исключен, так как по общему мнению данный вопрос решен в мировом сообществе: восстановление адекватного притока к ноге является залогом качества оказания помощи и не зависит от метода лечения (шунтирующие операции имеют схожие показатели отдаленной проходимости в сравнении с ЧКА) [24].
Восстановление кровотока по бедренно-подколенному сегменту
При планировании реконструкции бедренно-подколенного сегмента хирург сталкивается с выбором из 3 технологий: шунтирующая операция, ЧКА или ЧКА со стентированием. Современная хирургическая наука считает, что наиболее оптимальной ситуацией для выполнения ЧКА является короткий (до 10 см) стеноз или окклюзия поверхностной бедренной артерии (ПБА) [47]. В последнее время ведут работы по оценке безопасности выполнения ЧКА у больных с протяженным поражением, а также поражением, переходящим на подколенную артерию (C и D класс по классификации TASC II). Авторы демонстрируют высокий процент успешных ЧКА (около 94%) и удовлетворительные отдаленные результаты в сроки до 2 лет после выполнения вмешательства [23]. Такие результаты стали возможны с появлением гидрофильных проводников и техники субинтимальной ангиопластики. В большом метаанализе [18] продемонстрировано, что первичная ЧКА показывает схожие отдаленные результаты в сравнении с ЧКА+стентирование. В этой же работе отмечены схожие показатели качества жизни у больных обеих групп. В других исследованиях показано, что 2-летняя проходимость стентированного сегмента без поражения подколенной артерии достигает 87%, а при его поражении через 1 год работает всего 75% реконструкций [20, 46]. G. Rigatelli и соавт. [45] предложили использовать длительную баллонную ангиопластику с давлением 18 атмосфер в течение 2 мин с повторными сеансами, пока на ангиограмме не останется менее 30% резидуальных стенозов. По их данным, средняя продолжительность дилатации составила 5,9±1,9 мин с потребностью в имплантации стента у 11,9% из-за развившейся диссекции. Первичная проходимость зоны реконструкции составила 86,7% в течение 2 лет, что соответствует результатам с имплантацией покрытых стентов. Необходимо отметить, что более 60% больных в этой группе имели поражение TASC C.
Первичная хирургическая реваскуляризация сопровождается малой летальностью и практически 100% эффективностью в сохранении конечности больного. На основании данных литературы [35], можно утверждать об одинаковой степени сохранности конечности в ранние сроки после операции вне зависимости от используемого материала для шунтирования.
Бедренно-подколенное шунтирование (БПШ) на сегодняшний день является стандартной сосудистой операцией, обеспечивающей удовлетворительные результаты вне зависимости от протяженности поражения ПБА [42]. При оценке отдаленных результатов (до 5 лет) было показано, что проходимость аутовены почти в два раза выше, чем при использовании протеза (75% против 42% соответственно) [49]. С учетом этих данных при выполнении реконструкции рекомендуется использовать аутовенозный шунт из большой подкожной вены [2], однако описаны результаты эффективного применения трупных аллотрансплантатов в этой позиции [26, 39].
Последние чаще применяются при инфекции ранее установленного шунта, но стандартное применение их в качестве биологического материала позволит сократить сроки операции при удовлетворительных отдаленных результатах. Сохраненная собственная подкожная вена может быть в дальнейшем использована при реваскуляризации миокарда.
Для улучшения отдаленных результатов можно использовать гибридные операции — ЧКА в проксимальном отделе и БПШ коротким шунтом от дистального отдела ПБА до подколенной артерии (ПКА) [43]. В другом исследовании [51] продемонстрировано, что такой подход уменьшает число послеоперационных осложнений в 2 раза, но в отдаленном периоде показатели сохранения конечности остаются схожими с хирургической реваскуляризацией.
Сложностью реконструкции бедренно-подколенного сегмента является зависимость от состояния берцовых артерий. Чем лучше дистальное русло, тем лучше результаты. Учитывая, что около 17% больных имеют неудовлетворительное русло, необходимо продумывать тактику одновременного лечения на этом участке конечности [1].
По нашему мнению, при КИНК наиболее оправданным является этапная коррекция русла. Это связано с системными реакциями организма на пуск кровотока после длительной ишемии конечности [1]. Основной задачей хирурга является отбор группы больных, у которых сразу после восстановления кровотока по ПБА необходима реконструкция берцовых артерий ввиду высокого риска раннего тромбоза зоны реконструкции. Для этих больных, по нашему мнению, следует проводить ЧКА берцовых артерий. Для больных с удовлетворительным руслом показана изолированная реконструкция бедренно-подколенного сегмента с дальнейшими мероприятиями, направленными на улучшение кровотока по ноге.
Мы считаем, что у больных с КИНК на 1-м этапе следует проводить ЧКА ПБА без стентирования. Показанием к стентированию являются случаи диссекции интимы и значимого остаточного стеноза. Даже при условии малоудовлетворительных среднесрочных результатов такой подход позволит спасти конечность, начать реабилитацию и продолжить лечение уже в условиях хронической ишемии, используя все доступные методы коррекции дистального русла и/или повторных эндоваскулярных вмешательств. Также стоит учитывать, что ЧКА можно повторять «неограниченное» число раз для улучшения отдаленных результатов [3].
Восстановление кровотока по подколенно-берцовому сегменту
При атеросклеротическом поражении артерий ниже уровня коленного сустава хирурги сталкиваются с проблемой малой эффективности реконструктивных операций. Хирургическое лечение в этой области сопряжено с частой потерей конечности в результате быстрого тромбоза шунта [5, 11].
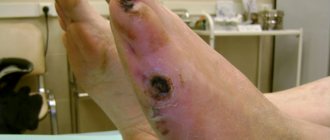
Использование эндоваскулярных методов позволяет улучшить отток по артериям голени, открыть окклюзии и, что важно, восстановить кровоток по плантарной дуге [7]. Последнее наиболее значимо для больных сахарным диабетом, а также в случаях угрозы малой ампутации. Проблема ЧКА заключается в быстром «рестенозе» берцовых артерий. При коррекции кровотока по голени состояние конечности возвращается на дооперационный уровень у 48% оперированных в течение 1 года [15, 33, 34]. Признаки рестеноза при контрольном обследовании обнаруживают у 2/3 больных уже через 3 мес [48]. Для больных сахарным диабетом эти результаты имеют меньшее значение — основной задачей при диабетической стопе является устранение трофических изменений (как главного инфекционного агента) за этот срок. Указанных 3 мес достаточно для решения этого вопроса у большинства больных [7]. Сохранение конечности у больных КИНК отмечено в 96,7% после выполнения ЧКА на уровне голени [17].
У больных с КИНК ампутация выполняется из-за недостатка кровоснабжения тканей. Перед хирургом встает выбор: для сохранения конечности требуется выполнение ангиопластики каждые 3—6 мес, что экономически не обосновано, или в эти сроки необходимо обеспечить альтернативный путь кровотока по голени и стопе.
Первый вариант имеет высокую трудозатратность и стоимость. Для выполнения изолированной ЧКА необходимо усовершенствование современного технического обеспечения и медикаментозных подходов к лечению. Наиболее распространенной практикой улучшения результатов ЧКА является имплантация стентов в зону стенозов после выполнения ангиопластики, однако в крупном метаанализе [50] продемонстрировано отсутствие эффективности такого подхода на периферических артериях.
После периферической ангиопластики всем больным на 3 мес назначают двойную антиагрегантную терапию, считается, что она улучшает отдаленные результаты [25]. В то же время непосредственно для стентирования берцовых артерий такие исследования не проводились. Цилостазол (сilostazol) также может являться препаратом, улучшающим результаты ЧКА на берцовом уровне. В других сосудистых бассейнах он позволяет значительно снизить частоту рестенозов и ампутаций [37, 40].
Второй путь подразумевает гибридный подход. Применение стимуляции ангиогенеза представляется оправданным способом. На сегодняшний день описаны два метода: терапевтический ангиогенез — введение мононуклеаров костного мозга, обогащенной тромбоцитами плазмы или генных препаратов [5, 13, 16, 30], и хирургический ангиогенез — за счет трансплантации большого сальника [10].
Терапевтический ангиогенез позволяет увеличить дистанцию безболевой ходьбы, уменьшить боли при КИНК и снизить частоту ампутаций [6]. В то же время метод достаточно новый и до сих пор у ученых нет точного представления механизма воздействия и частоты побочных явлений, особенно развития злокачественных новообразований. Хирургический ангиогенез в нашем понимании — это использование большого сальника для улучшения кровоснабжения тканей голени и стопы. Имплантация сальника на сосудистой ножке имеет два места приложения — закрытие дефектов кожных покровов и «прорастание» мышц конечности сосудами из жировой ткани. Основным ограничением для успешного применения трансплантации большого сальника при ишемии нижних конечностей является функциональное состояние регионарного кровообращения [14]. Свобода от ампутации у больных с КИНК в сроки до 5 лет при применении комбинированного лечения, шунтирующая операция совместно с имплантацией большого сальника на голень, достигает 87%, при этом у 42% полностью отсутствовали ограничения длительности ходьбы из-за перемежающейся хромоты [36].
Тактика реваскуляризации нижней конечности при критической ишемии
Эффективность борьбы за сохранение конечности при КИНК в большинстве случаев зависит от состояния дистального сосудистого русла. При минимальных изменениях берцовых артерий подходит любой способ реконструкции бедренно-подколенного сегмента. В крупном исследовании [19] продемонстрировано, что в сроки до 2 лет сохранение конечности схоже между БПШ и ЧКА ПБА, в большие сроки выявлено явное преимущество использования аутовены перед другими методами. Учитывая тяжесть состояния больного, вероятно, ЧКА является операцией выбора с дальнейшей подготовкой больного к выполнению дистального шунтирования.
При неудовлетворительном дистальном русле необходимо восстановить кровоток по максимальному числу берцовых артерий, используя ЧКА. Это позволяет хирургу стабилизировать клиническую ситуацию и дает время на подбор сбалансированной тактики и коррекцию сопутствующей патологии. Зачастую рестенозы развиваются в срок от 3 до 6 мес. За это время необходимо провести компенсацию конечности и, по возможности, улучшить объем принимающего дистального русла. Наиболее оправданной тактикой может являться применение методов ангиогенеза. Терапевтический ангиогенез достаточно слабо изучен, поэтому мы предлагаем использовать трансплантацию большого сальника. По нашему мнению, его необходимо пересаживать на сосудистой ножке. Артерией притока может являться любая дистальная ветвь глубокой артерии бедра. Эти ветви редко поражаются атеросклерозом и располагаются в стороне от мест доступа к ПБА. Важным хирургическим приемом считаем распределение массы большого сальника в зоне скопления основного мышечного массива и проведение его к дистальным отделам стопы.
Исходя из проанализированной литературы, эту операцию не желательно делать в острый период ишемии, так как для наилучшего приживления трансплантируемой ткани необходима компенсация кровотока по конечности. По нашему мнению, именно эта операция позволит наиболее длительно сохранить конечность.
Как возможный вариант следует рассматривать гибридную хирургию: БПШ + ЧКА берцовых артерий. Из недостатков метода можно отметить относительно короткий срок восстановления кровотока по голени, необходимость ежемесячного мониторирования проходимости берцовых артерий и выполнение повторной ЧКА при значимом стенозировании. Эти недостатки, вероятно, могут быть решены за счет применения современных антиагрегантных средств.
Преимущества лечения в ИСЦ
Техника бедренно-подколенного шунтирования в нашей клиники отработана до ювелирной точности. Мы используем эту оперцию чаще всего, как элемент гибридной хирургии при тяжелых поражениях артерий нижней конечности. Для улучшения результатов лечения пациентов с многоэтажными поражениями мы используем бедренно-подколенный шунт, через который затем выполняем ангиопластику и стентирование артерий голени. В качестве самостоятельной операции выполнять бедренно-подколенное шунтирование нет необходимости, так как при изолированной закупорке бедренной артерии у пациентов чаще всего серьезных жалоб нет.
Особенностями операции в нашей клинике является обязательный ультразвуковой контроль за кровотоком во время операции. При выявлении проблем в работе шунта мы выполняем рентгеновскую контрастную ангиографию и можем с помощью ангиопластики улучшить результаты вмешательства.
Подготовка к лечению
Подготовка к операции заключается в специальном обследовании, позволяющем определить характер поражения сосудов:
- УЗИ артерий нижних конечностей
- МСКТ аорты и артерий конечностей
Общем обследовании, определяющем сопутствующую патологию и риски операции:
- Эхокардиография (УЗИ сердца)
- Гастроскопия (ЭГДС)
- Рентгенография легких
- Комплекс анализов для госпитализации
Непосредственная подготовка к вмешательству:
- Бритье операционного поля от паха до средней трети голени проводится в день операции
- Не принимать пищу позже семи часов вечера накануне операции
- Очистительная клизма на ночь
- Установка мочевого катетера (непосредственно на операционном столе)
Зачем необходима процедура?
Эта операция выполняется при наличии стено-окклюзирующих поражений бедренных и подвздошных артерий. Помогает предотвратить развитие атеросклеротических процессов и избежать:
- недостатка кровоснабжения нижних конечностей;
- перемежающейся хромоты;
- утомляемости мышц голени, бедра и ягодиц;
- облитерирующего атеросклероза;
- язв;
- ишемии;
- гангрены;
- ампутации.
Восстановление аорты устраняет боли в области ягодицы, а бедренной и подвздошной артерий – в районе голени и бедра. Операция также является профилактикой ишемии стопы.
Обезболивание при лечении
Операция может проводится под местной, спинальной или эпидуральной анестезией. В нашей клинике используется преимущественно эпидуральная анестезия, так как эпидуральный катетер позволяет проводить эффективное обезболивание в послеоперационном периоде.
Катетер устанавливается в область поясницы с помощью укола специальной иглой. После проведения катетера в перидуральное пространство вводится небольшое количество анестетика, а пациент рассказывает о своих ощущениях. Постепенно доза увеличивается и отключается чувствительность в ногах, а затем и движения.
Во время операции доктор подключает к пациенту следящий монитор, который измеряет давление, с помощью манжеты на плече и снимает ЭКГ в трех отведениях. Кроме того, на палец кисти надевается специальный датчик — пульсоксиметр, который измеряет пульсовую волну и насыщение крови кислородом (сатурацию).
Как проходит метод лечения
Пациент укладывается на операционном столе на спину. Под колено больной ноги укладывается валик. Вся нога и паховая область обрабатывается специальным антисептическим раствором. Стопа укладывается в специальную пеленку, паховая область так же закрывается пеленкой.
Ревизия артерии оттока
Разрез для оценки артерии может быть в нижней трети бедра (выше колена) или сразу ниже коленного сустава, в зависимости от проходимости того или иного участка артерии по данным предварительного обследования. Длина разреза обычно 7-10 сантиметров.
После выделения артерии хирург оценивает ее плотность, наличие атеросклеротических бляшек, с помощью двухпинцетной пробы оценивается заполняемость артерии из голени. Если артерия признана пригодной для шунтирования, то она берется на держалку, если нет, то выделяется на другом участке.
Ревизия артерии притока и проксимальное (верхнее) соустье
Следующий разрез проводится в паховой области. Там должна быть выделена общая бедренная артерия, вместе с ветвями — глубокой и поверхностной. Этот участок артерии является местом, откуда будет запитываться шунт.
Если общая бедренная артерия пригодна как донорский сосуд , то производится ее пережатие сосудистыми зажимами. До этого внутривенно вводится раствор гепарина. После пережатия артерии она рассекается продольно, на 2-3 см. В разрез артерии обвивным швом вшивается сосудистый протез. Сразу после его вшивания зажимы снимаются, а протез заполняется физиологическим раствором с гепарином.
Проведение шунта
Следующим этапом создается тоннель под кожей, для проведения сосудистого протеза. Мы стараемся проводить протез как можно глубже, под мышцами, так как в случае инфекции в ранах, он не попадает в инфицированную зону.
Дистальный анастомоз (нижнее соустье)
Протез выводится в нижнюю рану, где в артерии так же делается продольный разрез, оценивается кровоток из низлежащих отделов. Протез пришивается сосудистым швом в рану артерии. Снимаются все сосудистые зажимы и запускается кровоток.
Контрольное исследование после реконструкции
В нашей клинике после этого всегда проводится интраоперационное УЗИ восстановленных артерий. Кровотока по шунту и подколенной артерии, а так же оценивается кровоток ближе к стопе. Обязательно проводятся пробы с пережатием шунта, чтобы оценить, насколько кровоток в ноге зависим от этого шунта.
Если при контрольном УЗИ выявляются проблемы с проходимостью артерии в анастомозе или в артериях ниже, высокое сопротивление по шунту, то мы проводим рентгеновскую ангиографию, для выявления возможных проблем. При обнаружении сужений сосудов мы выполняем ангиопластику или стентирование проблемных артерий.
Завершение операции
Проводится оценка кровоточивости анастомозов. Если кровотечения не отмечается, то в раны устанавливаются специальные силиконовые трубки (дренажи), которые подключаются к пластиковым грушам. Это необходимо для удаления скопления жидкости возле анастомозов и контроля за возможным кровотечением.
Раны пациента заклеиваются специальными повязками и он переводится в отделение для дальнейшего наблюдения.
Способ лечения окклюзий бедренно-подколенного артериального сегмента
Изобретение относится к медицине, а именно к сосудистой хирургии. Осуществляют подбор протеза и стента на баллонном катетере, выворачивают конец протеза в виде манжеты, проводят через протез баллонный катетер со стентом на 2/3 длины стента, сопоставляют соединяемые концы сосуда и протеза раздуванием баллона. При этом анастомоз формируют на границе начального и среднего отделов подколенной артерии. Для наложения анастомза конец-в-конец рассекают задне-латеральную стенку артерии и передне-медиальную полуокружность соустья формируют за счет артериальной стенки. При выполнении анастомоза конец-в-бок артериотомию производят в нижнем углу раны, анастомоз формируют с окклюзией отводящего участка подколенной артерии раздутым баллоном. Способ расширяет арсенал средств лечения окклюзии бедренной артерии при аллопластике бедренно-подколенного артериального сегмента. 4 ил.
Изобретение относится к медицине, а именно к сосудистой хирургии, и может быть использовано при формировании и реконструкции дистального анастомоза при аллопластике бедренно-подколенного артериального сегмента.
Хирургическое лечение больных с облитерирующим атеросклерозом сосудов нижних конечностей имеет многолетнюю историю и широко применяется в клинической практике. Однако ранние ретротромбозы отмечаются у 4-25% больных, причем бедренно-подколенные реконструкции осложняются в 10 раз чаще аорто-подвздошных. Поздние тромботические реокклюзии бедренно-подколенного сегмента встречаются в 22-60% случаев. В настоящее время многие авторы вариантом выбора шунта в бедренно-подколенной позиции выше щели коленного сустава считают синтетические протезы из политетрафторэтилена с преимущественным подкожным способом проведения трансплантата. В то же время максимальная проходимость протезов типа «GORE-TEX» в сроки до 5 лет не превышает 60%. Чаще всего причинами ранних тромбозов являются технические (стеноз анастомоза, углообразование протеза) и тактические погрешности, в этиологии поздних реокклюзий преобладают прогрессирование атеросклероза, неоинтимальная гиперплазия со стенозированием анастомозов, замедление и извращение процесса эндотелизации шунтов, перегибы протеза рубцами.
Из клинической практики авторам настоящего изобретения известно, протез из политетрафторэтилена не имеет гофр и плохо растягивается, при формировании анастомоза конец-в-бок необходимо добиваться острого угла между протезом и сосудом. В противном случае возможно складывание протеза у пятки анастомоза вплоть до стеноза или окклюзии на этом участке. Для обеспечения острого угла необходимо делать широкую артериотомию с длинным анастомозом. При формировании анастомоза с подколенной артерией: протез при выходе из тоннеля в подкожной жировой клетчатке идет к артерии под углом 60°, при этом нет необходимости делать продолженную артериотомию, можно ограничиться разрезом 10-12 мм. На внутренней поверхности ригидных, не способных к тангенциальному растяжению пористых синтетических протезов из политетрафторэтилена возникает утолщение интимы, что в большей степени определяется продольным растяжением. В связи с двунаправленным кровотоком в анастомозе конец-в-бок гиперплазия интимы, по теории Робичека, более выражена из-за локального гидрадинамического удара тока крови в стенку сосуда, именно поэтому приемущества имеют широкие анастомозы длиной до двух диаметров протеза. При подкожном проведении трансплантата и формировании широкого анастомоза конец-в-конец в жоберовой ямке складывание протеза происходит не у пятки, а на противоположной стороне, причем складка в дальнейшем фиксируется рубцами, что часто выявляется при тромбэктомии из протеза.
Проведенное изучение патентной и научно-медицинской литературы позволило выявить следующие способы формирования и реконструкции анастомозов при аллопластике бедренно-подколенного артериального сегмента.
Известен способ лечения окклюзии бедренной артерии [А 93031511], включающий забор вены, формирование нового русла комбинированным шунтом из синтетического протеза в дистальной части и аутовены по краям, протягивание шунта в подкожном слое и вшивание в артерию выше и ниже места окклюзии.
Недостатком способа является невозможность его использования для реконструкции анастомозов бедренно-подколенного политетрафторэтиленового протеза. При использовании способа возможно складывание протеза у пятки анастомоза вплоть до стеноза или окклюзии на этом участке, способ не позволяет обеспечить острый угол при формировании анастомоза с подколенной артерией.
Известен способ хирургического лечения ишемии нижних конечностей при окклюзирующих поражениях бедренно-подколенного сегмента [А 2000132996], включающий выделение участка ствола большой подкожной вены в области коленного сустава, максимально соответствующего по длине и диаметру подколенной артерии, помещение в просвет ствола большой подкожной вены, остающейся при этом в своем ложе тонкостенного политетрафторэтиленового протеза, выполненненого конусным с уменьшением диаметра в проксимальном направлении, формирование дистального анастомоза ствола большой подкожной вены и нижнего края протеза с подколенной артерией, выполнение проксимального анастомоза устья большой подкожной вены и верхнего края протеза с общей бедренной артерией.
Способ не может использоваться для реконструкции анастомозов бедренно-подколенного политетрафторэтиленового протеза, способ не предотвращает складывание протеза у пятки анастомоза, развитие стеноза или окклюзии в зоне дистального анастомоза.
Известен способ хирургической коррекции нарушений регионарной гемодинамики при облитерирующих заболеваниях артерий конечностей [А 2001113636], при котором после операции прямой реваскуляризации конечности формируют дистальную артериовенозную фистулу. Легируют проксимальный участок гемодинамически менее значимой артерии и дистальной сопровождающей ее вены. Создают анастомоз между дистальным концом артерии и проксимальным участком вены.
Способ невозможно использовать для формирования и реконструкции анастомозов при бедренно-подколенном шунтировании политетрафторэтиленовым протезом.
Известен способ лечения больных с окклюзионными заболеваниями артерий нижних конечностей [А 2004120892] путем шунтирования артерий и оперативного вмешательства, направленного на улучшение микроциркуляции, отличающийся тем, что при окклюзии подколенной и берцовых артерий проводят поясничную симпатэктомию и (или) реваскуляризирующую остеотрепанацию, а при окклюзии поверхностной бедренной артерии проводят бедренно-подколенное шунтирование.
Недостатком способа является отсутствие технических приемов, направленных на предупреждение реокклюзий при формировании и реконструкции дистальных анастомозов при аллопластике бедренно-подколенного артериального сегмента.
Известен способ лечения хронической ишемии нижних конечностей вследствие окклюзирующего поражения артерий голени [С 2257162]. Производят бедренно-берцовое шунтирование аутовеной, которую отставляют в своем ложе без выделения. Формируют проксимальный и дистальный анастомозы большой подкожной вены с общей бедренной и задней большеберцовой артериями. Дистальный анастомоз накладывают в нижней трети голени между задней большеберцовой артерией и большой подкожной веной бок-в-бок. При этом отрезок большой подкожной вены дистальнее анастомоза оставляют неперевязанным, разрушают в нем и в медиальной краевой вене клапаны до венозной дуги стопы. Оставляют истоки большой подкожной вены проходимыми. Не перевязывают вены-перфоранты на стопе.
Недостатками способа является то, что он не предназначен для лечения окклюзии бедренной артерии и дистального анастомоза при аллопластике бедренно-подколенного артериального сегмента, кроме того, выполнение способа сопряжено с высокой вероятностью развития тромбоэмболических осложнений в послеоперационном периоде.
Также известен способ хирургического лечения ишемии нижних конечностей при окклюзирующих поражениях артерий дистального русла [А 97118252], включающий аутовенозное шунтирование путем формирования дистального и проксимального анастомозов большой подкожной вены с большеберцовой и общей бедренной артериями, отличающийся тем, что большую подкожную вену оставляют в своем ложе, выделяя ее устье для формирования проксимального анастомоза и дистальный отдел ее ствола с притоком, имеющим достаточную длину и диаметр, максимально соответствующий большеберцовой артерии, которые после разрушения в них клапанов используют для формирования дистальных анастомозов соответственно с задней и передней большеберцовыми артериями.
Недостатками способа является то, что он не предназначен для лечения окклюзии бедренной артерии и дистального анастомоза при аллопластике бедренно-подколенного артериального сегмента, выполнение способа не всегда возможно в связи с анатомическими особенностями пациента (отсутствие соответствующего притока большой подкожной вены) и сопряжено с высокой вероятностью развития тромботических осложнений в послеоперационном периоде.
Известен способ восстановления магистрального артериального кровотока нижних конечностей [А 2004115305], отличающийся тем, что пациенту в положении лежа на животе доступом в подколенной ямке выделяют подколенную артерию, производят из нее полуоткрытую эндартерэктомию, а затем после переворота пациента на спину выполняют бедренно-подколенное шунтирование выше щели коленного сустава.
Недостатком способа является то, что он не предназначен для лечения окклюзии дистального анастомоза при аллопластике бедренно-подколенного артериального сегмента, кроме того, выполнение способа не предусматривает технических приемов, улучшающих гемодинамические условия в области бедренно-подколенного шунта, в частности «дастализации» отводящего анастомоза.
Прототипом настоящего изобретения как наиболее близкий по совокупности признаков к заявляемому способу выбран способ соединения кровеносного сосуда с протезом по Ратнеру Г.Л. [А 97121426], при котором подбирают протез и стент на баллонном катетере. Конец протеза выворачивают в виде манжеты. Проводят через протез баллонный катетер со стентом на 2/3 длины стента. Конец протеза вплотную придвигают к концу сосуда. Баллон умеренно раздувают, сопоставляя соединяемые концы сосуда и протеза. Предельным раздуванием баллона стент полностью раздувается, плотно прижимая стенку сосуда к протезу.
В заявленной авторами модификации способ имеет следующие недостатки. Способ непосредственно не предназначен для лечения окклюзии бедренной артерии и дистального анастомоза при аллопластике бедренно-подколенного артериального сегмента, технические приемы способа не способствуют предупреждению окклюзии и реокклюзий при формировании и реконструкции дистальных анастомозов при аллопластике бедренно-подколенного артериального сегмента.
Задачей заявляемого изобретения является предупреждение окклюзии и реокклюзий при формировании и реконструкции дистальных анастомозов при аллопластике бедренно-подколенного артериального сегмента.
Поставленная задача достигается тем, что анастомоз формируют на границе начального и среднего отделов подколенной артерии для наложения анастомоза конец-в-конец, рассекается задне-латеральная стенка артерии и передне-медиальная полуокружность соустья формируется за счет артериальной стенки, при выполнении анастомоза конец-в-бок артериотомия производится в нижнем углу раны, анастомоз формируется с окклюзией отводящего участка подколенной артерии раздутым баллоном, анастомоз «дистализируется» и формируется острый угол между трансплантатом и артерией, в ходе повторной операции стенозирующей складки передне-медиальной или задне-латеральной стенки протеза вблизи существующего «стандартного» анастомоза конец-в-бок суженный участок протеза иссекается, разрез продлевается на артерию, после наложения «страховочных» Z-образных швов в местах пересечения с линией анастомоза выполняется тромбинтимэктомия, в образованный дефект вшивается аутовенозная заплата.
Способ осуществляют следующим образом. Осуществляют доступ к бедренно-подколенному сегменту. Анастомоз формируют на границе начального и среднего отделов подколенной артерии. Для облегчения блокирования дистального отдела при формировании дистального анастомоза через просвет протеза в дистальный отдел артерии через протез вводят зонд Фогарти (фиг.1, 2, поз.1), баллон раздувают, за счет чего поддерживается кровоток и не требуется наложение дистального зажима, что позволяет выполнить анастомоз более дистально. Накладывают анастомоз конец-в-конец (фиг.1), при этом рассекают задне-латеральную стенку артерии и передне-медиальную полуокружность соустья формируют за счет более эластичной артериальной стенки. При выполнении анастомоза конец-в-бок (фиг.2) артериотомию производят в нижнем углу раны, анастомоз формируют с окклюзией отводящего участка подколенной артерии раздутым баллоном зонда Фогарти (фиг.2, поз.1) без использования сосудистого зажима, за счет чего происходит «дистализация» анастомоза с формированием острого угла между трансплантатом и артерией. При выявлении в ходе повторной операции стенозирующей складки передне-медиальной стенки (фиг.3, поз.1) протеза вблизи существующего «стандартного» анастомоза конец-в-бок суженный участок протеза иссекают, разрез продлевают на артерию, после наложения «страховочных» Z-образных швов в местах пересечения с линией анастомоза выполняют тромбинтимэктомию, в образованный дефект вшивают аутовенозную заплату (фиг.3, поз.2). При выявлении в ходе повторной операции стенозирующей складки задне-латеральной стенки (фиг.4, поз.1) протеза вблизи существующего «стандартного» анастомоза конец-в-бок суженный участок протеза иссекают, разрез продлевают на артерию, после наложения «страховочных» Z-образных швов в местах пересечения с линией анастомоза выполняют тромбинтимэктомию, в образованный дефект вшивают аутовенозную заплату (фиг.4, поз.2).
Способ опробован у 16 больных в отделении экстренной торакально-сосудистой хирургии МЛПУ ГорБСМП №2 г.Ростов-на-Дону.
Пример №1
Больной К, 56 лет, история болезни №20358, поступил 12.03.05. На фоне облитерирующего атеросклероза сосудов нижних конечностей установили окклюзию левой бедренной артерии. Осуществили доступ к бедренно-подколенному сегменту. Анастомоз сформировали на границе начального и среднего отделов подколенной артерии. Для облегчения блокирования дистального отдела при формировании дистального анастомоза через просвет протеза в дистальный отдел артерии через протез ввели зонд Фогарти, баллон раздули, за счет чего поддержали кровоток и не накладывали дистальный зажим. Выполнили анастомоз конец-в-конец, при этом рассекли задне-латеральная стенку артерии и передне-медиальную полуокружность соустья сформировали за счет более эластичной артериальной стенки. Течение послеоперационного периода гладкое, тромбоза анастомоза на протяжении 1 года не отмечено.
Пример №2
Больной Д, 67 лет, история болезни №190014, поступил 01.09.04. На фоне облитерирующего атеросклероза сосудов нижних конечностей установили окклюзию правой бедренной артерии. Осуществили доступ к бедренно-подколенному сегменту. При выполнении анастомоза конец-в-бок артериотомию произвели в нижнем углу раны, анастомоз сформировали с окклюзией отводящего участка подколенной артерии раздутым баллоном зонда Фогарти без использования сосудистого зажима, за счет чего произошла «дистализация» анастомоза с формированием острого угла между трансплантатом и артерией. Течение послеоперационного периода гладкое, тромбоза анастомоза на протяжении 1 года не отмечено.
Пример №3
Больная Ф, 62 лет, история болезни №232452, поступила 13.08.05. На фоне облитерирующего атеросклероза сосудов нижних конечностей, состояния после бедренно-подколенного шунтирования справа, установили реокклюзию дистального анастомоза шунта. Осуществили доступ к бедренно-подколенному сегменту. Выявили стенозирующую складку передне-медиальной стенки протеза вблизи существующего «стандартного» анастомоза конец-в-бок, суженный участок протеза иссекли, разрез продлили на артерию, после наложения «страховочных» Z-образных швов в местах пересечения с линией анастомоза выполнили тромбинтимэктомию, в образованный дефект вшили аутовенозную заплату. Течение послеоперационного периода гладкое, ретромбоза анастомоза на протяжении 1 года не отмечено.
Пример №4
Больной П, 63 лет, история болезни №218743, поступил 18.04.05. На фоне облитерирующего атеросклероза сосудов нижних конечностей, состояния после бедренно-подколенного шунтирования слева, установили реокклюзию дистального анастомоза шунта. Осуществили доступ к бедренно-подколенному сегменту. Выявили стенозирующую складку задне-латеральной стенки протеза вблизи существующего «стандартного» анастомоза конец-в-бок, суженный участок протеза иссекли, разрез продлили на артерию, после наложения «страховочных» Z-образных швов в местах пересечения с линией анастомоза выполнили тромбинтимэктомию, в образованный дефект вшили аутовенозную заплату. Течение послеоперационного периода гладкое, ретромбоза анастомоза на протяжении 1 года не отмечено.
По сравнению с прототипом предлагаемый способ позволяет исключить дополнительный изгиб проведенного в подкожном тоннеле тонкостенного протеза из политетрафторэтилена по дуге малого радиуса при формировании дистального анастомоза в жоберовой ямке и устранить его в ранее сформированных анастомозах. Способ позволяет во время операции бедренно-проксимально-подколенного протезирования (шунтирования) с подкожным проведением трансплантата из тонкостенного политетрафторэтилена при выполнении дистального анастомоза конец-в-конец рассекать задне-латеральную стенку артерии, а передне-медиальную полуокружность соустья формировать за счет более эластичной артериальной стенки, что позволят сформировать анастомоз в более выгодных гемодинамических условиях. Предложенный способ позволяет избежать образования стенозирующей складки по передне-медиальной стенке подкожно проведенного трансплантата вблизи анастомоза с последующей гиперпластической реакцией интимы и углубляющимся стенозом зоны анастомоза, то есть устранить непосредственную причину тромбоза и реокклюзии при реконструкции бедренно-подколенного сегмента.
Способ лечения окклюзии бедренной артерии при аллопластике бедренно-подколенного артериального сегмента, включающий подбор протеза и стента на баллонном катетере, выворачивание конца протеза в виде манжеты, проведение через протез баллонного катетера со стентом на 2/3 длины стента, сопоставление соединяемых концов сосуда и протеза раздуванием баллона, отличающийся тем, что анастомоз формируется на границе начального и среднего отделов подколенной артерии, для наложения анастомоза конец-в-конец рассекается заднелатеральная стенка артерии и переднемедиальная полуокружность соустья формируется за счет артериальной стенки, при выполнении анастомоза конец-в-бок артериотомия производится в нижнем углу раны, анастомоз формируется с окклюзией отводящего участка подколенной артерии раздутым баллоном, анастомоз «дистализируется» и формируется острый угол между трансплантатом и артерией.
Возможные осложнения при лечении
Бедренно-подколенное шунтирование является хорошо отработанной операцией и осложнения при ней встречаются редко. Однако иногда они все же случаются. Мы разделили их на несколько групп.
Осложнения во время операции:
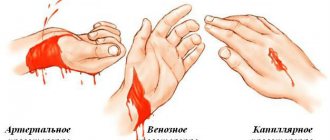
- Кровотечение — встречается очень редко, чаще при резком поражении артериальной стенки кальцинозом.
- Повреждение глубоких вен — крайне редкое осложнение, связанное с проведением держалки под артерией при выраженном спаечном процессе. Приводит к массивному венозному кровотечению.
- Повреждение близлежащих нервов — при хорошем знании анатомии практически не встречается. В последствие может быть снижение чувствительности кожи на ноге.
- Повреждение лимфатических сосудов — может наблюдаться при неправильном подходе к сосудистому пучку в паховой области, либо при повторных вмешательствах через рубцовые ткани.
Осложнения общего характера:
- Геморрагический шок — может наблюдаться при кровотечении во время операции.
- Инфаркт миокарда — редкое осложнение, наблюдаемое у пациентов с исходным тяжелым поражением коронарных артерий.
Послеоперационные осложнения:
- Кровотечение в послеоперационном периоде — случается чаще всего в первые сутки после операции, поэтому и устанавливается дренаж для контроля.
- Лимфоррея или лимфоцеле — истечение лимфатической жидкости из послеоперационной раны или скопление ее в подкожной клетчатке. Для коррекции требуются пункции скоплений жидкости или тщательные перевязки. Постепенно проходит самостоятельно.
- Лимфатический отек — может наблюдаться увеличение объема ноги на несколько сантиметров. Проходит в течение 2-3 месяцев.
- Нагноение протеза в позднем послеоперационном периоде — может возникнуть вследствие плохого заживления ран и при попадании инфекции на сосудистый протез. Осложнение очень опасное и чревато дополнительными осложнениями. При выявлении, требует удаления сосудистого протеза и повторной сосудистой операции для восстановления кровотока.
Публикации в СМИ
Острые окклюзии артерий — острое нарушение кровообращения дистальнее места окклюзии артерии эмболом или тромбом. Состояние считают неотложным. Проксимальнее и дистальнее участка окклюзии нарушается нормальный ток крови, что приводит к дополнительному тромбообразованию. Процесс может захватывать коллатерали, возможно распространение тромба вплоть до венозной системы. Состояние считают обратимым в течение 4–6 ч от его начала (в англоязычной литературе этот временной промежуток называют «золотым периодом»). По истечении этого времени глубокая ишемия ведёт к необратимым некротическим изменениям.
Статистические данные. Частота госпитализаций — 5–10:10 000 населения. Ведущая причина смерти и потери конечностей в пожилом возрасте. Преобладающий возраст — старше 60 лет. Преобладающий пол — мужской.
Этиология • Эмболия артерии — обтурация сосуда эмболом, мигрировавшим по току крови. Эмболии классифицируют в зависимости от первичного источника поражения •• Источник — левая половина сердца ••• Пристеночный тромб в результате аритмии, инфаркта, хирургической травмы, стеноза митрального клапана, эндокардита и сердечной слабости любой этиологии ••• Вегетации на клапанах ••• Инородные тела ••• Опухоли •• Источник — аорта ••• Склеротические бляшки ••• Травма с последующим тромбозом ••• Аневризма ••• Инородные тела •• Источник — лёгочные вены ••• Тромбоз ••• Травма с последующим тромбозом ••• Опухоли •• Источник — правое сердце: при дефектах межжелудочковой и межпредсердной перегородок •• Источник — вены большого круга кровообращения: при дефектах межжелудочковой и межпредсердной перегородок. • Тромбоз артерии. Патогенетическая триада Вирхова: повреждения сосудистой стенки, изменения состава крови, нарушения кровотока (его ламинарного течения) •• Повреждения сосудистой стенки ••• Облитерирующий атеросклероз ••• Артерииты: системные аллергические васкулиты (облитерирующий тромбангиит, неспецифический аортоартериит, узелковый периартериит), инфекционные артерииты ••• Травма ••• Ятрогенные повреждения сосудов ••• Прочие (при отморожении, воздействии электрического тока и т.д.) •• Заболевания крови: истинная полицитемия, лейкозы •• Заболевания внутренних органов (атеросклероз, гипертоническая болезнь, злокачественные опухоли и др.) •• Нарушения кровотока ••• Экстравазальная компрессия ••• Аневризма ••• Спазм ••• Острая недостаточность кровообращения, коллапс ••• Предшествующая операция на артериях.
Классификация острой ишемии конечности • Ишемия напряжения: отсутствие признаков ишемии в покое и появление их при нагрузке. • Ишемия I степени. Сохранены чувствительность и движения в поражённой конечности •• Ишемия IA степени характеризуется чувством онемения, похолодания, парестезиями •• При ишемии IБ степени появляются боли в дистальных отделах конечности. • Ишемия II степени. Характерны расстройства чувствительности, а также активных движений конечности: от пареза (степень IIА) до плегии (IIБ). • Ишемия III степени характеризуется начинающимися некробиотическими явлениями, что клинически выражается в появлении субфасциального отёка (IIIА), а позднее — мышечной контрактуры: парциальной (IIIБ) или тотальной (IIIВ).
Генетические аспекты. Возможно сочетание с наследственно обусловленным повышением свёртываемости крови и синдромами гиперлипидемий. Клинические проявления
• Пять основных симптомов — в англоязычной литературе симптомокомплекс «пяти P». (Если присутствует хотя бы один из этих признаков, показано плановое обследование с целью выявления окклюзии. Окклюзия сосудов, расположенных более проксимально, ведёт к более быстрому прогрессированию симптомов. Окклюзия на уровне бифуркации аорты может вызывать симптомы поражения с обеих сторон.) •• Боль (Pain) — локализуется дистальнее места окклюзии, разлитая, постепенно усиливается (иногда при спонтанном разрешении окклюзии исчезает). Чаще всего — первый признак эмболии. Не облегчается при изменении положения конечности •• Отсутствие пульса (Pulselessness) — обязательно для диагноза эмболии или тромбоза. У врачей часто отсутствует навык определения пульса на a. dorsalis pedis, что ведёт к диагностическим ошибкам. При определении пульса необходимо сравнивать его на обеих конечностях •• Бледность (Pallor) — цвет кожи сначала бледный, затем возникает цианоз. Температуру конечности следует проверять последовательно сверху вниз. Возможно наличие признаков хронической ишемии (атрофия кожи [сухость, морщинистость, шелушение], отсутствие волос, утолщение и ломкость ногтей) •• Парестезии (Paresthesia) — онемение, ощущение покалывания, ползания «мурашек» появляются на ранних стадиях тромбоза. Вначале исчезает тактильная чувствительность (ощущение прикосновения). При СД тактильная чувствительность может быть изначально снижена. Исчезновение болевой и глубокой чувствительности указывает на выраженную ишемию •• Паралич (Paralysis) — двигательная функция нарушается на поздних стадиях и указывает на глубокую ишемию.
• Наиболее частая локализация эмболии (по всем основным ветвям аорты) •• Бедренная артерия — 30% •• Подвздошная — 15% •• Подколенная — 10% •• Плечевая — 10% •• Бифуркация аорты — 10% •• Брыжеечные — 5% •• Почечные — 5%. • Определение уровня окклюзии на артериях •• Отсутствие пульса ниже и его усиление выше уровня окклюзии •• Симптомы обычно появляются на один сустав ниже уровня окклюзии. • Различия в клинической картине эмболии и тромбоза •• Эмболия ••• Часто предшествуют заболевания сердца: ревматический митральный стеноз, ИМ, миксома левого предсердия ••• Эмболия часто провоцируется нарушением ритма сердца ••• В иных случаях имеются аневризмы крупных артерий ••• Начало заболевания — внезапное с резчайшим болевым синдромом ••• Выше уровня эмболии — усиление пульсации артерии •• Тромбоз ••• В анамнезе — хронические заболевания сосудов (атеросклероз артерий либо эндартериит) ••• Предшествуют трофические нарушения: гипотрихоз конечности при атеросклерозе, гиперкератоз стоп, деформация ногтевых пластинок и т.п. ••• Симптомы появляются постепенно. Чаще первыми возникают парестезии, а затем уже боли ••• Систолический шум при аускультации выше места закупорки и над артериями непоражённой стороны ••• Могут предшествовать травмы либо вмешательства на сосудах.
Лабораторные данные • ПТИ повышается • Время кровотечения уменьшается • Фибриноген — содержание увеличивается • В послеоперационный период необходимо контролировать: •• Суточный диурез •• ОАМ •• КЩР •• Миоглобин сыворотки крови •• Мочевину сыворотки крови •• Электролиты сыворотки крови, в первую очередь калий.
Специальные исследования • Допплерография: наличие или отсутствие кровотока • Предоперационная ангиография. Если начало острое, присутствует источник эмболов в сердце и у больного не было предшествующей перемежающейся хромоты, то необходимости в предоперационной ангиографии нет. Дифференциальная диагностика • Расслаивающая аневризма брюшной аорты • Острый тромбофлебит глубоких вен конечности (белая болевая флегмазия).
ЛЕЧЕНИЕ Режим стационарный. Тактика лечения зависит от степени ишемии • Ишемия напряжения и IА степени — можно ограничиться консервативным лечением. При отсутствии эффекта в течение 24 ч у больного с эмболией сосуда либо в течение 7 сут у больного тромбозом необходима органосохраняющая хирургическая операция • Ишемия IБ–IIБ степеней — экстренная операция, направленная на восстановление кровотока (тромб- или эмболэктомия, реконструктивная операция обходного шунтирования) • Ишемия IIIА–IIIБ степеней — экстренная тромб- или эмболэктомия, обходное шунтирование, обязательно дополненные фасциотомией. В некоторых случаях операцию сопровождают регионарной перфузией конечности • Ишемия IIIВ степени — первичная ампутация поражённой конечности, т.к. восстановление кровотока может привести к аутоинтоксикации и гибели больного.
Консервативная терапия. При неэффективности медикаментозной терапии нельзя медлить с оперативным вмешательством, поскольку пассивная тактика может привести к гибели больного от нарастающей интоксикации. • Антитромботическая терапия •• Гепарин — сначала 100 ЕД/кг (5000–10 000 ЕД) в/в или 20 000–30 000 ЕД (1000–1500 ЕД/ч) в/в капельно, затем по 60 000–80 000 ЕД/сут (под контролем времени свёртывания крови, ЧТВ или МНО). Дробную гепаринизацию продолжают до 10 сут. За 1–3 дня до отмены гепарина начинают приём непрямых антикоагулянтов. Противопоказания: аллергические реакции, геморрагический диатез, травма (например, ЧМТ), гематурия, кровохарканье, остро развившаяся аневризма аорты •• Антикоагулянты непрямого действия: этил бискумацетат, фениндион. Действие непрямых антикоагулянтов контролируют, определяя ПТИ (удерживают на уровне 50–40% до тех пор, пока существует опасность тромбообразования). При кровотечении отменяют препарат, начинают введение менадиона натрия бисульфита, витамина Р, аскорбиновой кислоты, кальция хлорида, переливание тромбоцитарной массы, свежезамороженной плазмы крови •• Активаторы фибринолиза, например ксантинола никотинат •• Антиагреганты ••• Пентоксифиллин ••• Ацетилсалициловая кислота (нельзя назначать вместе с антикоагулянтами непрямого действия) ••• Дипиридамол.
• Фибринолитические средства (фибринолизин, стрептокиназа, стрептодеказа, алтеплаза [тканевой активатор плазминогена]). Противопоказаны больным с внутрисердечными тромбами в связи с опасностью развития повторных эмболий, а также при недавно перенесённом ИМ, аневризмах, расслаивающей аневризме аорты, инсульте, травмах, выраженной артериальной гипертензии, после недавно перенесённых операций. • Для улучшения кровообращения в ишемизированной конечности •• достаточно эффективен алпростадил — оказывает сосудорасширяющее, аниагрегантное действие, улучшает микроциркуляцию •• спазмолитические средства (папаверина гидрохлорид, дротаверин) гораздо менее эффективны •• физиотерапевтические процедуры (диадинамические токи, магнитотерапия, регионарная баротерапия) при удовлетворительном состоянии пациента. • Для улучшения тканевого метаболизма в зоне ишемии — ингибиторы протеаз (апротинин), антиоксиданты. • Для обеспечения высокого диуреза (предпочтительно 100 мл/ч) — инфузионная терапия. Хирургическое лечение • Непрямая эмбол- и тромбэктомия. Чаще всего используют баллонный катетер Фогэрти • Эндартерэктомия и обходное шунтирование — при неприменимости метода Фогэрти.
Послеоперационное ведение — антикоагулянтная терапия для предупреждения повторной эмболии и ретромбоза. Осложнения • Ацидоз, миоглобинурия, гиперкалиемия • Рецидив окклюзии • Стойкая окклюзия вследствие невозможности устранить тромб или эмбол • Реперфузионный синдром — синдром, возникающий при восстановлении кровотока в ишемизированной конечности; по своим проявлениям сходен с позиционной травмой и отчасти синдромом длительного сдавления •• Предрасполагающие факторы: сочетанное поражение артерий, глубокая и длительная ишемия, артериальная гипотензия •• Наблюдают как в верхних, так и в нижних конечностях •• Клинические признаки ••• Выраженные боли в покое ••• Гипестезия областей иннервации поражённых нервов ••• Паралич мышц поражённой конечности дистальнее бывшей окклюзии ••• Болезненный напряжённый отёк ••• Интоксикация (рвота, сильная головная боль, нарушение сознания) ••• Олигурия •• Ранние последствия нераспознанного реперфузионного синдрома: сепсис, миоглобинурия и почечная недостаточность, шок, синдром полиорганной недостаточности •• Поздние последствия нераспознанного реперфузионного синдрома: ишемические контрактуры, инфекции, каузалгии, гангрена.
Течение и прогноз • 90% благоприятных исходов при своевременном лечении • Позднее начало лечения или его отсутствие обусловливают летальный исход или утрату конечности • Госпитальная смертность — 20–30% в зависимости от причинных факторов.
МКБ-10 • I74 Эмболия и тромбоз артерий • I74.2 Эмболия и тромбоз артерий верхних конечностей • I74.3 Эмболия и тромбоз артерий нижних конечностей • I74.9 Эмболия и тромбоз неуточнённых артерий.
Прогноз после метода лечения
Если операция выполняется по строгим показаниям, то ее результаты очень хорошие. Более 80% бедренно-подколенных шунтов функционируют в течение 5 лет. Если постепенно развивается закрытие этого шунта, то организм компенсирует кровоток в обход этого сегмента и больной может и не почуствовать, что шунт перестал работать.
Вторичные осложения после бедренно-подколенного шунтирования развиваются у 10% больных. Чаще всего это ранний тромбоз шунта. Такой исход наступает при недооценке состояния сосудистого русла оперирующим хирургом, либо при нарушении приема антитромботических препаратов. Для предупреждения этого осложнения проводится регулярный контроль состояния шунта с помощью УЗИ.
Ранний тромбоз шунта может привести к развитию критической ишемии или гангрены. Своевременное повторное вмешательство позволяет сохранить ногу и недопустить ампутации.
Программа наблюдения после метода лечения
Эффективная и долговременная работа бедренно-подколенного шунта невозможна без детальной оценки его работоспособности. Чаще всего проводится ультразвуковое ангиосканирование артерий оперированной конечности.
Первый осмотр после выписки должен проводится через месяц после операции. Оценивается состояние ран на бедре, наличие отека и расстройств чувствительности, объем движения пациента, расстояние безболевой ходьбы. При УЗИ артерий оценивается состояние анастомозов и скорость кровотока по артериям на стопе.
Последующие осмотры рекомендуется проводить каждые 6 месяцев после операции. Спустя год желательно выполнить МСКТ артерий нижних конечностей с контрастированием. Либо это исследование может назначить ваш сосудистый хирург по результатам периодического осмотра.