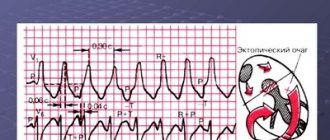
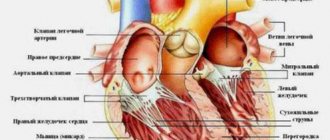
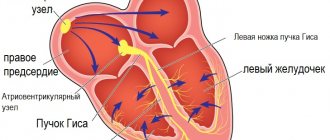
Желудочковая тахикардия (ЖТ) – вид пароксизмальной тахикардии (ссылка на страницу). Характеризуется нарушением синусного ритма и увеличением числа сокращений желудочков. Причиной заболевания служит изменения со стороны мышцы сердца или проводящей системой желудочков сердца, вследствие чего реализуется механизм re-entry (круговой аритмии), либо часть клеток сердца начинают проявлять повышенную электрическую активность, что приводит к ускоренной работе желудочков сердца.
Во время приступа частота сердечных сокращений (ЧСС) колеблется от 140 до 220 ударов в минуту. Среди всех нарушений ритма ЖТ самая опасная, т.к. она может трансформироваться в жизнеугорожающую аритмию – фибрилляцию желудочков. Кроме того, во время приступа желудочки сокращаются часто, но не в полном объеме. Это может привести к недостаточности кровоснабжения головного мозга и вызвать потерю сознания.
Что вызывает желудочковую тахикардию?
Что вызывает желудочковую тахикардию?
Желудочковая тахикардия чаще всего возникает у пациентов с органическими изменениями сердца, например, инфаркт миокарда, кардиомиопатия, миокардит. Рубцовая ткань создает аномальные электрические пути, заставляя сердце биться с высокой частотой. Иногда у людей без заболеваний сердца может развиться желудочковая тахикардия. Она легче поддается лечению и обычно не опасна для жизни.
Народные средства
Фото: rusteaco.ru
При желудочковой тахикардии использование народных методов лечения возможно в качестве дополнения к медикаментозной терапии, назначенной врачом. Настойки и настои трав помогут снизить частоту сердечных сокращений, но не стоит забывать, что они действуют очень мягко, поэтому применяются вне обострений болезни. Наиболее популярны следующие растения:
- Мелиса. Настойку принимают по 4 чайные ложки в день, предварительно разбавив их 50 мл воды.
- Девясил. Для приготовления настойки используются корни растения. Дозировка: по 1 чайной ложке 3 раза в день за 15 минут до еды.
- Валериана. Измельченные корни (1 ст.л) заливают водой и настаивают. Принимают по 100 мл 1 раз в день.
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.
Какие симптомы желудочковой тахикардии?
Какие симптомы желудочковой тахикардии?
По причине того, что во время желудочковой тахикардии сокращения желудочков не синхронизированы с предсердиями, возникает хаотичное сердцебиение, препятствующее достаточному наполнению кровью камер сердца, в результате чего, сердце не способно перекачать нужное количество крови к жизненно важным органам. Это может привести к потере сознания. Однако клинические проявления желудочковой тахикардии могут различаться. Иногда короткие эпизоды желудочковой тахикардии могут длиться секунды и не вызывать каких-либо заметных симптомов. В других случаях продолжительный эпизод (обычно более 30 секунд) может привести к серьезным симптомам, таким как:
Сердцебиение Головокружение Одышка Боль в груди Потеря сознания
Желудочковая тахикардия иногда представляет серьезную опасность, приводя к более тяжелому, жизнеугрожающему состоянию — фибрилляции желудочков. Это состояние, при котором желудочки сердца как будто бы дрожат и перекачивают очень малое количество крови. Фибрилляция желудочков — самая распространенная причина развития внезапной сердечной смерти.
Диагностика
Фото: sante.by
Обследование пациентов с нарушениями сердечного ритма проводит врач-кардиолог. Диагностика проводится комплексно и включает следующие методы:
- Сбор жалоб и данных анамнеза. У большинства больных, обратившихся к врачу, есть характерные симптомы тахикардии: учащенное сердцебиение, боли в груди, головокружения. У большинства подтверждено наличие сердечной патологии, например, инфаркт миокарда в анамнезе.
- Физикальное обследование. Методом пальпации определяется учащение пульса от 100 до 220 ударов за 1 минуту. Ритм чаще правильный. Также характерно снижение артериального давления.
- Лабораторные методы. В результатах биохимического анализа крови отмечается снижение уровня электролитов: калия, магния, кальция. Пациентам старше 40 лет рекомендуется исследование уровня липидов в крови и коагулограмма.
- Инструментальная диагностика. Желудочная тахикардия подтверждается данным электрогардиограммы. График имеет множество особенностей, которые могут быть расшифрованы только врачом. Наиболее распространенные особенности: широкие QRS комплексы (более 0,12 секунды), диссоциация зубцов Р и наджелудочковых «захватов», униформность QRS векторов (грудные отведения). Дополнительные методы исследования – суточное мониторирование ЭКГ по Холтеру, пробы с физическими нагрузками, ЭХО-КГ.
Как диагностируется желудочковая тахикардия?
Как диагностируется желудочковая тахикардия?
Диагностировать желудочковую тахикардию можно с помощью электрокардиограммы в момент приступа. Для длительной записи электрокардиограммы при подозрении на желудочковую тахикардию используют холтеровский монитор — непрерывная запись ЭКГ в течение времени. Могут потребоваться дополнительные обследования, такие как эхокардиография, МРТ сердца, стресс-тест или коронарография, чтобы определить наличие структурных заболеваний сердца.
Ю.А. Бунин РМАПО, Москва
Желудочковые нарушения ритма сердца (ЖНРС) и, в первую очередь, желудочковые тахикардии, чаще всего ассоциированные с ИБС и ее осложнениями или наследственной генетической патологией, представляются наиболее важными факторами риска развития внезапной сердечной смерти (ВСС). Так, причиной ВСС в развитых странах в 75-80 % случаев является фибрилляция желудочков (ФЖ) и значительно меньшую роль в ее развитии играют брадиаритмии. В то же время в ряде случаев ЖНРС у больных без органического поражения сердца и не имеющих генетических заболеваний (синдром удлиненного или укороченного интервала QT, синдром Бругада, аритмогенная кардиомиопатия правого желудочка и др.), вероятно, не оказывают значительного отрицательного влияния на прогноз жизни.
Электрокардиографическая, электрофизиологическая диагностика и клинические проявления желудочковых тахикардий На ЭКГ желудочковую тахикардию (ЖТ) диагностируют при наличии трех или более идущих друг за другом преждевременных желудочковых комплексов, ширина которых, как правило, превышает 0,12 сек (чаще 0,14 сек и более). Редко комплексы QRS при ЖТ могут быть узкими (0,12 сек и менее), в частности, когда место образования импульса находится в непосредственной близости от бифуркации пучка Гиса и антероградно импульс распространяется на желудочки по его ветвям. Выделяют мономорфную (форма комплексов QRS во время тахикардии не изменяется) и полиморфную ЖТ, при которой желудочковые комплексы изменяют свою морфологию. Особый вид полиморфной ЖТ, возникающей у больных с удлиненным интервалом QT, называют тахикардией типа «пируэт», или «torsades de pointes». Как и наджелудочковые тахиаритмии, ЖТ могут быть пароксизмальными и непароксизмальными (хроническими). Если тахикардия продолжается более 30 сек, ее относят к категории устойчивых ЖТ, а спонтанно прекращающаяся менее чем за 30 сек называется неустойчивой. ЖТ надо дифференцировать с наджелудочковой тахикардией (НЖТ) с аберрацией (необычным проведением импульса по желудочкам), так как оба этих нарушения ритма имеют вид тахикардии с регулярными широкими комплексами QRS. Причинами аберрации являются блокада ветви пучка Гиса, предшествующая тахикардии или тахизависимая во время ее, и проведение суправентрикулярного импульса по добавочному внеузловому предсердно-желудочковому пути (ДПП). Клиническая значимость дифференциальной диагностики не вызывает сомнений из-за различий в прогнозе и подходов к лечению НЖТ и ЖТ. Обычно она проводится на основании анализа поверхностной ЭКГ, но в сложных случаях приходится прибегать к внутрисердечному ЭФИ. Необходимо отметить, что ЖТ является самой частой причиной тахикардий с широкими комплексами QRS. Ниже перечисляются наиболее важные электрокардиографические критерии диагностики ЖТ. 1. Наличие признаков атриовентрикулярной (АВ) диссоциации: независимое от комплексов QRS расположение зубцов Р, регистрация «захваченных» и/или «сливных» желудочковых комплексов. Когда ретроградное проведение желудочковых импульсов на предсердия сохраняется, зубцы Р, следующие за комплексами QRS, инвертированы в отведениях II, III, AVF. 2. Ширина желудочковых комплексов более 0,14 сек (комплексы QRS, как при блокаде правой ветви пучка Гиса) или более 0,16 сек (комплексы QRS, как при блокаде левой ветви пучка Гиса). Эти признаки не помогают в дифференциальной диагностике, когда на синусовом ритме уже существовала блокада ветви пучка Гиса, и в случаях распространения наджелудочкового импульса по дополнительному пути или предшествующего использования антиаритмиков 1С класса: у больных с НЖТ продолжительность желудочкового комплекса может быть более 0,14 сек (тахикардия «БВП-тип») и более 0,16 сек (тахикардия «БЛВ-тип»). 3. Расстояние от начала зубца R до надира (самой низкой точки зубца S) превышает 0,1 сек в одном из грудных отведений. 4. Конкордантные комплексы QRS во всех грудных отведениях (положительные или отрицательные). Однако положительные конкордантные желудочковые комплексы могут быть при антидромной АВРТ (локализация ДПП в задней стенке слева). 5. Если желудочковые комплексы напоминают блокаду правой ветви пучка Гиса: монофазные или двухфазные комплексы QRS в отведении V1 и RS (R 6. Если желудочковые комплексы напоминают блокаду левой ветви пучка Гиса: ширина зубца r в отведении V1 и V2 превышает 0,03 сек, а расстояние от начала желудочкового комплекса до надира зубца S превышает 0,06 сек. В отведении V6 может быть небольшой зубец q при большом зубце R или желудочковый комплекс в виде QS. 7. При наличии блокады ветви пучка Гиса на синусовом ритме, тахикардия с широкими комплексами QRS, отличающимися от таковых на синусовом ритме, вероятнее всего желудочковая. Электрофизиологически ЖТ характеризуется наличием короткого или «негативного» (т. е. регистрируемого после желудочкового комплекса) интервала НV или даже отсутствием потенциала пучка Гиса (совпадает с желудочковым комплексом). Индуцируемая желудочковой стимуляцией тахикардия по конфигурации комплексов QRS, как правило, аналогична спонтанной. Длительное (холтеровское) мониторирование ЭКГ дает дополнительную важную информацию о количественных и качественных характеристиках эпизодов симптомной и бессимптомной (чаще неустойчивой) ЖТ, что важно для определения тактики ведения больных и выделения групп высокого риска по внезапной смерти. Говоря о диагностике ЖТ, необходимо отметить и определенное значение сигнал-усредненной электрокардиографии, регистрирующей поздние желудочковые потенциалы, которые отражают очаги медленного проведения миокарда, являющиеся субстратом для развития аритмий по механизму re-entry. До 85 % больных с устойчивой ЖТ имеют положительную (регистрация поздних потенциалов) сигнал-усредненную электрокардиограмму. У больных, перенесших ИМ, с отрицательной сигнал-усредненной ЭКГ и нормальной сократительной функцией левого желудочка развитие желудочковых аритмий представляется маловероятным. В то же время регистрация поздних желудочковых потенциалов у больных с постинфарктным кардиосклерозом и фракцией выброса менее 40 % указывает на 30-40 %-ный риск появления опасных желудочковых аритмий или внезапной смерти [2]. Более чем у 60 % больных с устойчивой мономорфной желудочковой тахикардией ее причиной является ишемическая болезнь сердца. При этом значительная часть из них имеет в анамнезе инфаркт миокарда (ИМ), нередко осложненный выраженной систолической дисфункцией левого желудочка. Около 75 % больных, реанимированных в связи с остановкой сердца, болели ИБС. Возникновение устойчивой ЖТ позднее 48 часов от начала ИМ ассоциируется с высоким риском рецидива аритмии и увеличением летальности. Если антиаритмическая терапия не проводится, смертность в течение года у этих больных составляет от 50 до 70 %. С другой стороны, ускоренный идиовентрикулярный ритм, появившийся в ранние сроки острого инфаркта миокарда, не ухудшает прогноза. Менее значительную группу ЖТ представляют больные с дилятационной и гипертрофической кардиомиопатиями, приобретенными клапанными и некоторыми врожденными пороками сердца, врожденным удлинением или укорочением интервала QT, аритмогенной дисплазией правого желудочка, синдромом Бругада. Выделяют также идиопатическую ЖТ (первичная электрическая болезнь сердца), при которой прогноз хороший. Средний возраст больных с ЖТ превышает 50 лет, и 2/3 из них составляют лица мужского пола. Длительное время наиболее цитируемой классификацией желудочковых аритмий (ЖА) была классификация В. Lown, в которой они были разделены на пять градаций, а в основе этого деления лежала преимущественно их электрокардиографическая количественная и морфологическая характеристика. Однако, как известно, степень риска развития фатальных ЖА, а следовательно, и прогноз больных зависит не только от самого нарушения ритма, но и от других факторов, включающих функциональное состояние миокарда, коронарного кровотока, состояние вегетативной иннервации сердца и др. В связи с вышесказанным большое практическое значение имеет клиническая классификация J.T. Bigger [3], хотя и она теперь представляется не достаточно полной. В отличие от классификации В. Lown в нее включена не только количественная оценка желудочковых нарушений ритма, но и анализ их клинических проявлений, а также структурных поражений миокарда. В классификации J.T. Bigger все ЖА делятся на три группы: доброкачественные, потенциально злокачественные и злокачественные. К доброкачественным ЖА в настоящее время относят желудочковую экстрасистолию любых градаций, протекающую без нарушений гемодинамики, у больных без органического заболевания сердца. Прогноз у этих больных хороший, и показаний к проведению антиаритмической терапии нет. Исключение составляют случаи необходимости улучшения качества жизни при плохой субъективной переносимости аритмий. Важным отличием потенциально злокачественных желудочковых аритмий от доброкачественных является наличие органического заболевания сердца, особенно с признаками дисфункции левого желудочка. Наибольшую группу среди них составляют больные, перенесшие ИМ. У этих лиц увеличен риск (по J.T. Bigger – «средний риск») внезапной смерти из-за развития фибрилляции желудочков. Около 20 % больных с постинфарктным кардиосклерозом имеют потенциально злокачественные желудочковые аритмии. У больных, перенесших ИМ, при наличии желудочковой экстрасистолии (более 10 в час) риск внезапной смерти возрастает в два раза и в два-четыре раза при регистрации неустойчивой ЖТ. Основной целью лечения больных с потенциально злокачественными ЖА является уменьшение смертности. Для ее выполнения надо применять антиаритмические препараты, эффективность которых (увеличение выживаемости) доказана в крупных контролируемых исследованиях. Попытки использовать любые антиаритмики для подавления желудочковой эктопической активности при выполнении этой задачи могут в ряде случаев привести к ухудшению прогноза жизни (табл. 1). Для иллюстрации данного положения можно сослаться на многоцентровые, рандомизированные плацебо-контролируемые исследования CASTI и CASTII [4, 5], в которых изучалось влияние антиаритмической терапии препаратами 1С класса (флекаинид, энкаинид, морицизин – аналог отечественного этмозина) на выживаемость больных с желудочковой экстрасистолией, перенесших ИМ. Оба исследования были досрочно прекращены из-за значительного и достоверного увеличения смертности у больных, принимавших антиаритмики, по сравнению с группой плацебо. В других исследованиях было показано, что применение антиаритмиков 1А и 1В классов (хинидин, дизопирамид, мексилетин) у этой категории больных также сопряжено с риском увеличения смертности [6]. Однако ряд клинических исследований и их мета-анализ продемонстрировали, что b-адреноблокаторы без собственной симпатомиметической активности (пропранолол, метопролол, атенолол, тимолол и некоторые другие), применяемые в достаточно высоких дозах, уменьшают общую смертность на 20-25 % у больных группы высокого риска, перенесших ИМ с зубцом Q. По данным мета-анализа 13 рандомизированных плацебо-контролируемых исследований, включавших 6553 больных с постинфарктным кардиосклерозом и/или застойной сердечной недостаточностью, которые имели потенциально злокачественные ЖА, амиодарон снижает общую смертность на 13 % (р = 0,03) и внезапную смерть на 29 % (р = 0,003) [7]. Необходимо отметить, что детальный анализ исследований с амиодароном указывает на то, что он уменьшает общую смертность преимущественно у больных с неишемической кардиомиопатией и неустойчивой ЖТ, сочетающихся с низкой фракцией выброса (в среднем менее 40 %). Это довольно отчетливо было продемонстрировано в исследованиях GESICA [8] и CHF-STAT [9]. Эффективность комбинации амиодарона с b-блокаторами у больных, перенесших ИМ, проанализирована в двух крупных исследованиях EMIAT (European myocardial infarct amiodaron trial) и CAMIAT (Canadian amiodaron myocardial infarction trial): сердечная смерть, а также аритмическая смерть плюс реанимированные в связи с остановкой сердца достоверно реже встречались у больных, получавших b-блокаторы и амиодарон, чем при применении только амиодарона или плацебо [10]. Следовательно, если у больного, перенесшего ИМ и принимающего b-блокатор, планируется назначение амиодарона для лечения симптоматической аритмии, лечение b-блокатором должно быть продолжено. В то же время в двойном слепом плацебо-контролируемом исследовании (1456 больных, перенесших ИМ) соталол хотя и снижал общую смертность на 18 %, эти данные были статистически не достоверны [14а]. Не оказывает влияние на смертность больных, перенесших ИМ, и больных с сердечной недостаточностью новый антиаритмик 3 класса дофетилид [14б]. Определенный интерес представляет исследование МАDIТ (Multicenter automatic defibrillator trial), в котором сравнивалась эффективность имплантированных кардиовертеров-дефибрилляторов (ИКД) и антиаритмических препаратов (80 % больных получали амиодарон) в первичной профилактике смерти у больных ИБС после инфаркта миокарда с ФВ менее 35 % и неустойчивой ЖТ, у которых при ЭФИ индуцировалась устойчивая ЖТ. Исследование было досрочно прекращено из-за более высокой выживаемости больных с ИКД [14]. Важное значение для первичной профилактики смерти имеют результаты исследования MADITII, в котором продемонстрировано снижение смертности на 31 % у больных, перенесших ИМ и имевших ФВ 30 % и менее с ИКД, по сравнению с группой подобных больных, получавших традиционную медикаментозную терапию (b-блокаторы, ингибиторы АПФ и др.) [14в]. Таким образом, для улучшения прогноза жизни больных, перенесших ИМ и имеющих потенциально злокачественные ЖА, показано назначение b-блокаторов без собственной симпатомиметической активности и, вероятно, амиодарона. Амиодарон, очевидно, является препаратом выбора для лечения симптоматических аритмий у больных с сердечной недостаточностью. Имплантация кардиовертера-дефибриллятора рекомендуется больным, у которых через месяц после инфаркта миокарда ФВ остается менее 30 % независимо от наличия или отсутствия ЖНРС. Нецелесообразно применение антиаритмиков 1 класса как у этих больных, так и при сердечной недостаточности любой другой этиологии из-за их неблагоприятного влияния на гемодинамику и прогноз. Высокий риск внезапной смерти у больных со злокачественной (жизнеопасной) желудочковой аритмией (ЗЖА), к которой относятся устойчивая желудочковая тахикардия, сопровождающаяся, как правило, тяжелыми нарушениями гемодинамики, и фибрилляция желудочков (после успешной реанимации). У большинства из этих больных значительно нарушена систолическая функция левого желудочка и низкая фракция выброса. Целью лечения больных с жизнеопасными желудочковыми аритмиями является как предупреждение рецидивов ЖТ, так и увеличение продолжительности жизни. У 80 % из них диагностируется ИБС и в меньшем количестве случаев кардиомиопатии и клапанные пороки сердца. В современной клинической практике для определения прогноза у больных с органическим поражением сердца, кроме устойчивой и неустойчивой ЖТ, желудочковой экстрасистолии (10 и более в час), ухудшения сократимости миокарда (ФВ менее 35-40 %), учитываются и такие показатели, как снижение вариабельности ритма сердца, дисперсия интервала QT, альтернация зубца Т. Дисфункция левого желудочка и возможность индукции ЖТ во время электрофизиологического исследования считаются наиболее важными предвестниками плохого прогноза.
Лечение ЖТ Купирование пароксизмальной мономорфной ЖТ В настоящее время можно признать, что лидокаин не самый эффективный препарат для купирования ЖТ, но он быстро начинает действовать и дает мало осложнений. В ряде исследований показан более высокий эффект новокаинамида и соталола. Сравнивая эффективность в/в введения новокаинамида (10 мг/кг) и лидокаина (1,5 мг/кг) в купировании 41 эпизода устойчивой мономорфной ЖТ А.Р.M. Gorgels et al. [15] установили, что эффективность новокаинамида достоверно выше. Им прекращено 20 из 26 эпизодов ЖТ, тогда как лидокаином только 4 из 15 (р В 1995 г. D. Scheinman et al. [16] опубликовали данные рандомизированного двойного слепого исследования, проведенного в 46 медицинских центрах США, в котором сравнивалась эффективность различных схем в/в введения амиодарона у больных с жизнеопасными желудочковыми аритмиями: в/в капельная инфузия амиодарона в суточной дозе около 1000 мг (после начального быстрого нагрузочного в/в введения 150 мг за 10 мин) на 40-60 % чаще прекращала аритмии, чем при использовании двух других изучавшихся схем. При в/в введении амиодарона, кроме того, действие препарата проявляется довольно поздно. У 50 % больных эффект наступает в промежутке от двух до шести часов от начала применения препарата [17]. При купировании устойчивой ЖТ необходимо учитывать как эффективность антиаритмика, так и состояние сократительной функции миокарда. В связи с этим для купирования мономорфной ЖТ у больных с нормальной сократительной функцией миокарда предлагается использовать новокаинамид, соталол, лидокаин и амиодарон, отдавая предпочтение первым двум препаратам, а при нарушенной сократительной функции миокарда (застойная сердечная недостаточность или фракция выброса менее 40 %) рекомендуется в/в введение только лидокаина или амиодарона [17а]: • новокаинамид 1,0-1,5 г (до 17 мг/кг): в/в инфузия со скоростью 30-50 мг/мин. Для предотвращения рецидивов ЖТ в/в капельное введение со скоростью 1-4 мг/мин; • соталол 1,0-1,5 мг/кг: в/в введение со скоростью 10 мг/мин; • лидокаин 1,0-1,5 мг/кг: в/в введение за 2 мин. При отсутствии эффекта и стабильной гемодинамике продолжить его в/в введение по 0,5-0,75 мг/кг каждые 5-10 мин. У больных с застойной сердечной недостаточностью или ФВ менее 40 % целесообразно применение меньших доз: в/в 0,5-0,75 мг/кг за 2 мин. При неэффективности – повторное в/в введение в той же дозе каждые 5-10 мин. Суммарная доза препарата, вводимого за один час, во всех случаях не должна превышать 3 мг/кг. С целью предупреждения рецидивов пароксизмов аритмии проводится в/в инфузия лидокаина со скоростью 1-4 мг/мин; • амиодарон: в/в 150 за 10 мин, затем инфузия 360 мг в течение 6 часов (1 мг/мин) и 540 мг в последующие 18 часов (0,5 мг/мин). При рецидивах аритмии дополнительно в/в вводится по 150 мг амиодарона за 10 мин. Максимальная суммарная доза антиаритмика за 24 часа составляет 2,2 г. У больных с тяжелым поражением миокарда и снижением его сократительной функции возможно дробное в/в введение амиодарона в небольших дозах (по 150 мг через 10-15 мин, продолжительность каждого введения 10 мин); • если ЖТ не купируется антиаритмическими препаратами или осложняется тяжелыми нарушениями гемодинамики, проводится синхронизированная ЭИТ, при которой мощность первого разряда составляет 50-100 Дж.
Купирование пароксизмальной полиморфной ЖТ При нормальной продолжительности интервала QT купирование ЖТ проводится практически так же, так и у больных с мономорфной ЖТ. При сохраненной сократительной функции миокарда применяют лидокаин, амиодарон, новокаинамид, соталол, при сниженной сократимости миокарда – лидокаин, амиодарон. Если полиморфная ЖТ развивается у больных с приобретенным удлиненным интервалом QT (тахикардия типа «пируэт», «torsades de pointes»), прежде всего надо отменить препараты, которые могли привести к удлинению интервала QT (антиаритмики 1 и 3 классов, психотропные препараты, антибиотики и т. д.) и провести, при необходимости, коррекцию электролитических нарушений (гипокалиемии, гипомагнезиемии). При приступах аритмии, не нарушающих гемодинамику, проводится мониторное наблюдение за ЭКГ, а для уменьшения риска ее рецидива учащается ритм до 90-110 в минуту с помощью временной ЭКС или в/в инфузии изопротеренола. Для купирования пароксизмов ЖТ типа «пируэт» применяют в/в введение сернокислой магнезии (1-3 г за 2-5 мин) или лидокаина (1-1,5 мг/кг за 2 мин), а также ЭИТ с мощностью первого разряда не менее 200 Дж. По данным центра по мониторингу за лекарственными препаратами ВОЗ (WHO drug monitoring centre), количество зарегистрированных полиморфных ЖТ у больных с удлиненным интервалом QT значительно возросло за последние 10 лет. Анализ 20 лекарств, применение которых наиболее часто ассоциируется с удлинением интервала QT и возникновением тахикардии типа «torsades de pointes», проведенный в этом центре, показал, что в процентном отношении к общему числу побочных реакций наиболее часто эту аритмию вызывают антиаритмики ибутилид (24,9 %) и соталол (4,7 %), антагонист кальция бепридил (3,9 %). У амиодарона и антиаритмических препаратов 1А и 1С классов это отношение существенно меньше: у амиодарона – 0,34, хинидина – 0,45 и флекаинида – 0,29 % [18]. Таким образом, можно констатировать, что инциденты тахикардии «пируэт» при применении амиодарона довольно редки по сравнению с другими антиаритмическими препаратами 3 класса. Тем не менее, контроль за продолжительностью интервала QT при использовании антиаритмиков 1А, 1С классов и амиодарона также необходим.
Профилактика рецидивов устойчивой ЖТ и возможности улучшения прогноза при жизнеопасных (злокачественных) ЖА Для профилактического лечения ЖТ используются в основном антиаритмические препараты 1 и 3 классов. Антиаритмики 2 класса (b-адреноблокаторы) могут быть эффективны при ЖТ, возникающей во время физической нагрузки, а также у больных с синдромом врожденного удлинения интервала QT. Антиаритмик 4 класса верапамил предупреждает рецидивы некоторых видов идиопатической ЖТ. Редкие, кратковременные, нетяжелые пароксизмы ЖТ (как правило, это идиопатическая ЖТ) не требуют лечения. Оценка эффективности фармакотерапии при частых симптоматических приступах ЖТ проводится по клиническим данным (влиянию на частоту рецидивов аритмии), а при редких и тяжелых пароксизмах ЖТ – с использованием специальных исследований: неинвазивных (холтеровское мониторирование ЭКГ у больных с частой желудочковой экстрасистолией и/или пробежками неустойчивой ЖТ, проб с дозированной физической нагрузкой) и инвазивных (внутрисердечного ЭФИ). С помощью длительного мониторирования ЭКГ определяется возможность подавления, а при физической нагрузке – невозможность индукции или учащения желудочковых аритмий на фоне перорального приема антиаритмических препаратов. Установлено, что в случае положительных результатов неинвазивных тестов профилактическая терапия этими препаратами будет у большинства больных предотвращать рецидивы желудочковых тахиаритмий (ЖТ/ФЖ). Внутрисердечное ЭФИ позволяет судить об эффективности антиаритмика по способности провоцировать пароксизм ЖА эндокардиальной стимуляцией правого желудочка. Значимость неинвазивного и инвазивного тестирования в предсказании эффективности фармакотерапии приблизительно одинакова. Однако, по некоторым данным, ЭФИ более чувствительно в выявлении аритмогенного действия антиаритмических препаратов и поэтому обеспечивает большую безопасность их использования [18а]. Из табл. 2 видно, что амиодарон и соталол эффективнее антиаритмиков 1 класса в предупреждении рецидивов жизнеопасных ЖА и увеличении выживаемости, а имплантируемые кардиоверторы-дефибрилляторы, в свою очередь, превосходят эти антиаритмические препараты 3 класса в улучшении прогноза жизни. Поэтому для больных, которые выжили после остановки кровообращения (фибрилляции желудочков) или имеют устойчивую ЖТ с тяжелыми гемодинамическими нарушениями и плохую сократительную функцию миокарда левого желудочка (ФВ Фармакотерапию злокачественных желудочковых аритмий (ЗЖА) надо начинать с амиодарона или соталола, а при отсутствии эффекта от них или наличии противопоказаний необходимо тестирование других антиаритмиков (в т. ч. 1 класса) и, вероятно, комбинаций антиаритмических препаратов. Ранее уже указывалось, что амиодарон относительно редко приводит к развитию тяжелых аритмогенных эффектов и, прежде всего, ЖТ (в т. ч. типа «пируэт»), несмотря на удлинение интервала QT. Соталол, являясь высокоэффективным антиаритмиком [24], может давать ряд осложнений, преимущественно в первые три-четыре дня от начала лечения (симптоматические брадиаритмии – 10-15 %, желудочковые аритмии – 4-5 %) [25, 26]. Поэтому в эти дни необходим тщательный ЭКГ и клинический контроль, особенно при назначении больших доз антиаритмика, так как проаритмические эффекты соталола являются дозозависимыми. Подобрать антиаритмическую терапию, используя антиаритмические средства всех классов, удается только у 50-60 % больных с жизнеопасными желудочковыми аритмиями [18а]. Эффективность фармакотерапии уменьшается пропорционально снижению сократительной функции миокарда левого желудочка. У больных, перенесших остановку сердца, которым подобрана антиаритмическая терапия (невозможность повторной индукции ЗЖА с помощью ЭФИ), смертность составляет при длительном наблюдении (до трех лет) от 0 до 22 % (в среднем 9 %). При рефрактерности к медикаментозному лечению – от 22 до 78 % (в среднем 43 %) [27]. Если фармакотерапия ЗЖА не дает положительных результатов, необходимо оценить возможности немедикаментозных методов лечения. Радиочастотная катетерная деструкция наиболее эффективна при некоторых типах идиопатической ЖТ. По данным североамериканского общества по стимуляции и электрофизиологическим исследованиям (NASPE, 1992), эффективность РКД у них составляет 85 %. У больных с постинфарктным кардиосклерозом и дилятационной кардиомиопатией количество положительных результатов существенно меньше (около 50 %), поэтому РКД у них чаще используется как дополнение к имплантации кардиовертера-дефибриллятора для уменьшения частоты пароксизмов ЖТ и, следовательно, количества наносимых ИКД разрядов. Хирургическое лечение ЖТ в первую очередь показано больным с сегментарным повреждением миокарда (постинфарктный рубец, аневризма) и сохраненной сократительной функцией левого желудочка. Когда имеется застойная сердечная недостаточность и/или низкая фракция выброса, а это большинство больных со ЗЖА, результаты оперативного вмешательства (аневризмэктомия, эндокардиальная вентрикулотомия, субэндокардиальная резекция) значительно хуже. В связи с этим хирургическое лечение ЗЖА в развитых странах в настоящее время используется относительно редко, а предпочтение отдается имплантации кардиовертеров-дефибрилляторов, проводящейся без торакотомии. Первое сообщение об имплантации кардиовертера-дефибриллятора опубликовано М. Мirowski et al. в 1980 г. [28]. К 1995 г. КД были имплантированы более чем 150 тыс. больных. Операционная летальность при имплантации без торакотомии низкая и колеблется от 0 до 1,3 % (в среднем менее 0,5 %). По мнению экспертов американских коллегии кардиологов и ассоциации сердца [29], имплантация кардиовертера-дефибриллятора является наиболее эффективным методом лечения ЗЖА. Основными показаниями для имплантации кардиовертера-дефибриллятора являются: 1) остановка сердца, вызванная ФЖ или ЖТ, но не связанная с преходящими или обратимыми причинами (уровень доказательства А); 2) спонтанная устойчивая ЖТ у больных с органическим поражением сердца (уровень доказательства В); 3) синкопальные состояния неизвестного происхождения, при которых с помощью ЭФИ индуцируется устойчивая ЖТ с гемодинамическими нарушениями или ФЖ, а фармакотерапия не эффективна или имеется непереносимость лекарств (уровень доказательства В); 4) неустойчивая ЖТ у больных ИБС, перенесших ИМ и имеющих дисфункцию ЛЖ, у которых при электрофизиологическом исследовании индуцируется ФЖ или устойчивая ЖТ, не купирующаяся антиаритмиками 1 класса (уровень доказательства В); 5) больные с ФВ ЛЖ не более 30 %, остающейся через месяц после ИМ или через три месяца после операции реваскуляризации миокарда. Имплантация кардиовертера-дефибриллятора не рекомендуется: 1) больным, у которых пусковой механизм аритмии может быть идентифицирован и устранен (электролитные нарушения, передозировка катехоламинов и др.); 2) больным с синдромом Вольфа-Паркинсона-Уайта и фибрилляцией предсердий, осложненной фибрилляцией желудочков (им должна быть проведена катетерная или хирургическая деструкция добавочного пути); 3) больным с желудочковыми тахиаритмиями, которые могут провоцироваться электрической кардиоверсией; 4) больным с синкопальными состояниями неизвестной причины, у которых желудочковые тахиаритмии не индуцируются при электрофизиологическом исследовании; 5) при непрерывно рецидивирующей ЖТ или ФЖ; 6) при ЖТ или ФЖ, которые поддаются лечению катетерной аблацией (идиопатические ЖТ, фасцикулярная ЖТ).
Литература 1. Myerburg R.J., Kessler K.M., Kimura S. Life-threatening ventricuar arrhythmias: the link between epidemiology and pathophysiology. In Zipes D.P., Jalife J. (eds). Cardiac electrophysiology. Philadelphia: W.B. Saunders company. 1994, p. 723. 2. Gomes J.A., Winters S.L., Stewart D. et al. A new noninvasive index to predict sustained ventricular tachycardia and sudden death in the first year after miocardial infarction: Based on signal-averaged electrocardiogram, radionuclide ejection fraction, and Holter monitoring. J. Am. Coll. Cardiol. 1987; 10: 349-357. 3. Bigger J.T. Identification of patients at high risk for sudden cardiac death. Am. J. Cardiol. 1984; 54: 3D-8D. 4. Cardiac arrhythmia suppression trial (CAST) investigators. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N. Engl. J. Med. 1989; 321: 406-412. 5. Effect of the antiarrhythmic agent moricizine on survival after myocardial infarction. The cardiac arrhythmia suppression trial II investigators. N. Engl. J. Med. 1992; 327: 227-233. 6. Morganzoth J., Goin J.E. Qinidine-related mortality in the short-to-medium term treatment of ventricular arrhythmias: a meta-analysis. Circulation. 1991; 84: 1977-1983. 7. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in cogestive heart failure: meta-analysis of individual data from 6500 patients in randomised trials. Lancet. 1997; 350: 1417-1424. 8. Doval H.C., Nul D.R., Grancelli H.O. et al. Nonsustained ventricular tachycardia in severe heart failure. Independent markers of increased mortality due to sudden death. GESICA-GEMA investigators. Circulation. 1996; 94: 3198-3203. 9. Singh S.N., Fletcher R.D., Fisher S.G. et al. Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure. N. Engl. J. Med. 1995; 333: 77-82. 10. Boutitie F., Boissel J-P., Stuart J. et al. Amiodarone interaction with b-blokers. Analysis of merged EMIAT and CAMIAT databases. Circulation. 1999; 99: 2268-2275. 11. A randomized trial of propranolol in patients with acute myocardial infarction. JAMA 1982; 247: 1707-1714. 12. Julian D.G., Camm A.J., Frangin G. et al. Randomised trial of effect of amiodarone on mortality in patients with left-ventricular dysfunction after recent myocardial infarction: EMIAT. Lancet. 1997; 349: 667-674. 13. Cairns J.A., Connoly S.J., Roberts R., Gent M. Randomised trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarisations: CAMIAT. Lancet. 1997; 349: 675-682. 14. Moss A.J., Hall W.J., Cannom D.S. et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. N. Engl. J. Med. 1996; 335: 1933-1940. 14a. Julian D.G., Prescott R.J., Jackson F.S., Szekely D. Controlled trial of sotalol for one year after myocardial infarction. Lancet. 1982: 1142-1147. 14б. Sager P.T. New advances in class III antiarrhythmic drug therapy. Gurr. Opin. Cardiol. 2000; 15: 41-53. 14в. Moss A.J., Zareba W., Hall W.J. et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduce ajection fraction. N. Engl.J.Med. 2002; 346: 877-883. 15. Gorgels A.P.M., Adri van den Dool, Hofs A. et al. Comparison of procainamide and lidocaine in terminating sustained monomorphic ventricular tachycardia. Am. J. Cardiol. 1996; 78: 43-46. 16. Scheinman M.M., Levine J.H., Cannom D.S. et al. Dose-ranging study of intravenous amiodarone in patients with life-threatening ventricular tachyarrhythmiass. Circulation. 1995; 92: 3264-3272. 17. Moos A.N., Mohiuddin S.M., Hee T.T. et al. Efficacy and tolerance of high-dose intravenous amiodarone for recurrent refractory ventricular tachycardia. Am. J. Cardiol. 1990; 65: 609-614. 17a. Guidelines 2000 for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2000; 102 (Suppl I): I-158-165. 18. Darp_ B. Spectrum of drugs prolonging QT interval and the incidence of torsades de pointes. Eur. Heart J. Supplements 2001; 3 (Suppl K): K70-K80. 18a. Голицын С.П. Лечение желудочковых аритмий с позиции первичной и вторичной профилактики внезапной смерти // Сердечная недостаточность. 2001. № 2. С. 201-208. 19. Mason J.W. A comparison of seven antiarrhythmic drugs in patients with ventricular tachyarrhythmias. N. Engl. J. Med. 1993; 329: 452-458. 20. Greene H.L. The CASCADE study: randomized antiarrhythmic drug therapy in survivors of cardiac arrest in Seattle. CASCADE investigators. Am. J. Cardiol. 1993; 72: 70F-74F. 21. Siebels J., Cappato R., Ruppel R. et al. Preliminary results of the cardiac arrest study Hamburg (CASH). CASH investigators. Am. J. Cardiol. 1993; 72: 109F-113F. 22. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. The Antiarrhythmics Versus Implantable Defibrillators (AVID) investigators. N. Engl. J. Med. 1997; 337: 1576-1583. 23. Cappato R. Secondary prevention of sudden death: the Dutch Study, the Antiarrhythmics Versus Implantable Defibrillators Trial, the Cardiac Arrest Study Hamburg, and the Canadian Implantable Defibrillator Study. Am. J. Cardiol. 1999; 83: 68D-73D. 24. Kehoe R.F. MacNeil D.J. , Zheutlin T.A. et al. Safety and efficacy of oral sotalol for sustained ventricular tachyarrhythmias refractory to other antiarrhythmic agents. Am. J. Cardiol. 1993; 72: 56A-66A. 25. Soyka L.F., Wirtz C., Spangenberg R.B. Clinical safety profile of sotalol in patients with arrhythmias. Am. J. Cardiol. 1990; 65: 74A-81A. 26. Chung M.K., Schweikert R.A., Wilkoff B.L. et al. In hospital admission for initiation of antiarrhythmic therapy with sotalol for atrial arrhythmias required? JACC. 1998; 32: 169-176. 27. Myerburg R.J., Castellanos A. Clinical trials of implantable defibrillators. N. Engl. J. Med. 1997; 337: 1621-1623. 28. Mirowski M., Reid P.R., Mower M.M. et al. Termination of malignant ventricular arrhytmias with an implanted automatic defibrillator in human beings. N. Engl. J. Med. 1980; 303: 322. 29. ACC/AHA guideliness for implantation of cardiac pacemakers and antiarrhythmia devices. Circulation. 2002; 106: 2145-216.
Как лечить желудочковую тахикардию?
Очень важно, чтобы выявить причину желудочковой тахикардии для наиболее эффективного лечения.
Основные методы лечения желудочковой тахикардии следующие:
| Кардиоверсия | Антиаритмики | Кардиовертер- дефибриллятор | Радиочастотная катетерная аблация |
| Устойчивая желудочковая тахикардия нередко требует срочного лечения. Электрическая кардиоверсия — это процедура, при которой с помощью внешнего дефибриллятора и нанесения электрического тока происходит восстановление нормального ритма сердца. | Эти препараты при длительном приеме могут предотвращать новые приступы аритмии. Антиаритмики также могут использовать для срочного восстановления правильного ритма, тогда они вводятся внутривенно. | Пациентам с высоким риском развития желудочковой тахикардии имплантируют кардиовертер-дефибриллятор. Это устройство вживляется под кожу грудной клетки и при возникновении аритмии автоматически посылает в сердце электрический разряд, благодаря чему сердце возвращается к нормальному ритму. | Эта процедура используется для разрушения небольших участков сердечной ткани, ответственных за возникновение аритмии. Катетерная аблация может снизить количество эпизодов или полностью избавить от желудочковой тахикардии. У пациентов без патологии миокарда желудочковая тахикардия успешно лечится с помощью катетерной аблации и является терапией первой линии. Современные технологии позволяют хирургу точно выявить патологический путь аритмии и устранить аномальные сигналы, способствующие возникновению тахикардии. Процедура аблации желудочковой тахикардии при структурных заболеваниях сердца может быть более длительной и сложной. |
Среднее время прочтения — 3 минуты.
Лекарства
Фото: zagranmaster.ru
Основная группа медикаментов, используемая для лечения желудочковой тахикардии – антиаритмические препараты. Теоретически могут быть назначены лекарства I, II и III класса. Однако большой практический опыт позволил разделить их на три порядка по убыванию эффективности. К лекарственным средствам первого порядка относятся препараты, которые дают заметный положительный результат в 70% случаев. Пример такого препарата – Амиодарон. Однако список им не ограничивается, подбор наиболее безопасного и эффективного лекарства производится врачом.
Категорически запрещено самостоятельное лечение антиаритмическими лекарствами, так как они способны спровоцировать побочные реакции вплоть до летального исхода. Даже у наиболее безопасных лекарств данной группы частота нежелательных эффектов колеблется от 4-8% до 25-30%. Начинать лечение стоит под постоянным контролем частоты сердечных сокращений и под наблюдением врача.
Профилактика
Чтобы в будущем не сталкиваться с вопросом, как лечить тахикардию, врачи рекомендуют:
- отказаться от курения и употребления алкоголя;
- контролировать артериальное давление;
- включить в рацион больше овощей, фруктов и ограничить потребление животных жиров;
- контролировать уровень холестерина в крови;
- ежегодно проходить осмотр у кардиолога
.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Советы специалиста
Желудочковая тахикардия – опасное состояние. Для снижения вероятности развития острого приступа, хочу дать следующие рекомендации:
- постоянно принимать лекарства, которые нормализуют ритм и состояние сердечной мышцы;
- исключить стрессовые ситуации;
- придерживаться правильного питания;
- заниматься физическими упражнениями в пределах возрастной нормы, но не перегружаться;
- исключить из рациона продукты и напитки, способные вызвать учащение пульса;
- не использовать народные средства в качестве единственно возможного варианта лечения.
Описание случая
Пациент Д
., 21 года, родившийся и проживающий в горных районах северо-восточной части Кавказа, был госпитализирован в ФГБУ НМИЦ эндокринологии МЗ РФ для уточнения гормональной активности инциденталомы правого надпочечника (выявленной по данным УЗИ при случайном обследовании по месту жительства). При поступлении предъявлял жалобы на одышку, головокружение, повышение артериального давления (АД) до 170/100 мм рт.ст., учащенное сердцебиение. Из анамнеза известно, что вскоре после рождения у пациента выявлен врожденный порок сердца – двуприточный единственный анатомически левый желудочек, комбинированный стеноз легочной артерии, добавочная верхняя полая вена, дренирующаяся в коронарный синус, аортолегочные коллатерали от нисходящей аорты к обоим легким. В возрасте одного года пациенту был наложен двунаправленный кавапульмональный анастомоз. В 2021 г. была рекомендована операция Фонтена (формирование анастомоза между нижней полой веной и легочными артериями). В 2021 г. при подготовке к хирургическому лечению порока сердца было выявлено бессимптомное повышение АД до 220/110 мм рт.ст., при УЗИ обнаружено объемное образование правого надпочечника 46×36 мм с четкими контурами. Уровень кортизола крови – 464,2 нмоль/л; дальнейших обследований не проводилось. При холтеровском мониторировании ЭКГ были зарегистрированы миграция водителя ритма по предсердиям, пробежки суправентрикулярной тахикардии, эпизоды идиовентрикулярного ритма с ЧСС 60–70 в мин, в связи с чем направлен на стационарное обследование в ФГБУ НМИЦ эндокринологии МЗ Р.Ф. За 2 нед до госпитализации с целью уточнения гормональной активности объемного образования надпочечника терапия бета-блокаторами была отменена. На момент госпитализации получал верапамил 240 мг в сутки, доксазозин 0,2 мг в сутки, контроль АД осуществлял нерегулярно.
Результаты физикального, лабораторного и инструментального исследования
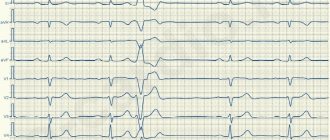
При поступлении на ЭКГ регистрировалась желудочковая тахикардия (рис. 1),
Рис. 1. Электрокардиограмма при поступлении. Регистрируется мономорфная желудочковая тахикардия. которая сопровождалась артериальной гипотонией до 90/70 мм рт.ст.
Тахикардия длилась от нескольких минут до 1 часа, купировалась спонтанно, но рецидивировала. Для контроля ритма больному был отменен верапамил, перорально назначены амиодарон в насыщающих дозах (200 мг 2 раза в день), бета-адреноблокаторы (метопролола сукцинат 12,5 мг 2 раза в день с последующим увеличением до 25 мг 2 раза в день), продолжена терапия альфа-адреноблокаторами (доксазозин 6 мг 2 раза в сут). В течение 2 сут удалось достичь устойчивого синусового ритма. В то же время развилось повышение АД до 200/100 мм рт.ст., в связи с чем к терапии была добавлена пролонгированная форма нифедипина 30 мг на ночь, иАПФ (эналаприл 5 мг 2 раза в день).
Клинико-лабораторное обследование:
При ЭхоКГ (рис. 2)
Рис. 2. Данные эхокардиографии. а – короткая парастернальная позиция на уровне митрального клапана; б – верхушечная 4-х камерная позиция, диастола; в – верхушечная 4-х камерная позиция, систола. отмечалась митральная и трикуспидальная регургитация II–III степени, функционирующее овальное окно диаметром 4–5 мм, единственный двуприточный левый желудочек, фракция выброса левого желудочка – 75%.
При компьютерной томографии выявлено образование правого надпочечника с четкими и ровными контурами, размером 39×37×43 мм, нативная плотность – 44 HU.
В суточной моче зарегистрировано изолированное повышение норметанефринов до 15 367 мкг/сут (норма 35–445). Лабораторных данных, позволяющих предположить гиперальдесторонизм и гиперкортицизм, не получено.
Дифференциальный диагноз
Для исключения МЭН-синдрома проведено УЗИ щитовидной и околощитовидных желез, дополнительных образований не выявлено, также были исключены функциональные нарушения щитовидной железы. Таким образом, была диагностирована ФХ.
Лечение
Назначен доксазозин в начальной дозе 6 мг в сут, рекомендовано оперативное лечение в объеме правосторонней адреналэктомии.
Учитывая часто рецидивирующую желудочковую тахикардию, сердечную недостаточность, пациенту была продолжена терапия амиодароном (400 мг в сут) и метопрололом (50 мг в сут). Для достижения оптимальных показателей АД были назначены эналаприл 10 мг в сут, нифедипин 30 мг в сут.
Исход и результаты последующего наблюдения
Спустя 5 мес пациент был вновь госпитализирован в ФГБУ НМИЦ эндокринологии МЗ Р.Ф. Назначенной ранее терапии пациент придерживался, за прошедшее время доза доксазозина была увеличена до 16 мг в сут. На этом фоне достигались показатели АД в пределах 110–170/70–100 мм рт.ст. На сериях ЭКГ регистрировалась синусовая тахикардия с ЧСС 90–100/мин, жалоб на нарушения ритма сердца пациент не предъявлял, синкопальных и предсинкопальных состояний не отмечал.
На момент госпитализации симптомы ХСН выражены умеренно, на уровне 2-го функционального класса по NYHA. По данным Холтеровского мониторирования ЭКГ, желудочковых нарушений ритма не было.
Учитывая персистирующее повышение уровня калия в крови (до 5,8 ммоль/л) и креатинина (до 123 мкмоль/л, рСКФ по CKD-EPI – 72 мл/мин/1,73 м2), иАПФ были отменены. В связи с высокой ЧСС покоя (90–100/мин) была увеличена доза метопролола сукцината до 50 мг в сут. Блокатор кальциевых каналов (нифедипин) был отменен в связи с оптимальным контролем АД на фоне терапии альфа- и бета-адреноблокаторами. Терапия амиодароном была продолжена.
В условиях отдела хирургии ФГБУ НМИЦ эндокринологии МЗ РФ пациенту была выполнена лапароскопическая правосторонняя адреналэктомия. Полученный гистологический материал соответствовал феохромоцитоме альвеолярного типа гистологического строения с фиброзной дегенерацией в центре. Послеоперационный период протекал без особенностей, рецидивов желудочковой тахикардии не отмечалось, АД контролировалось оптимально. Пациент был выписан на 10-е сутки после оперативного вмешательства и направлен к кардиохирургам для проведения хирургического лечения порока сердца.
Причины возникновения
Чаще всего тахикардия развивается из-за ишемии миокарда, в том числе кардиосклероза после инфаркта или формирования аневризмы. Кроме того, нарушение ритма может появиться в следующих случаях:
- дилатационная или гипертрофическая кардиомиопатия;
- нарушение структуры клапанов.
Другие причины:
- операции на сердце;
- эндокринные и неврологические патологии;
- изменение баланса электролитов;
- передозировка препаратами (сердечными гликозидами, бета-блокаторами, антиаритмическими средствами);
- алкогольная интоксикация;
- употребление наркотиков (кокаина).
Иногда органическая причина нарушения ритма отсутствует, но у человека развивается эктопический (аномальный) очаг возбуждения в миокарде. В этом случае речь идет об идиопатическом типе отклонения – то есть о расстройстве без видимой причины. Оно может быть приступообразным или устойчивым. По моим наблюдениям, второй вариант отличается более благоприятным течением и лучше поддается лечению, особенно при желудочковой пароксизмальной тахикардии.
Диета при тахикардии
При тахикардии рекомендуется отказаться от:
- кофеинсодержащих напитков и продуктов;
- алкоголя;
- острых, соленых, копченых и жирных блюд;
- соусов;
- жирных сливок и сметаны;
- продуктов, в состав которых входит сода;
- вареных и жареных яиц.
Ежедневное меню должно включать:
- натуральные соки;
- овощи;
- фрукты;
- молоко;
- кисломолочные продукты;
- диетическое мясо.
Питание должно быть регулярным, небольшими порциями. От приема пищи перед сном следует отказаться. Сладости ограничить. Отдавать предпочтение низкокалорийным продуктам, богатым калием и магнием. Раз в неделю желательно проводить разгрузочные дни (оптимальный вариант – растительные).
Лечение тахикардии сердца
Принципы терапии напрямую зависят от причин, из-за которых появилась тахикардия сердца. Лечение должно осуществляться исключительно опытным врачом. В рамках терапии необходимо не только устранить симптом, но и избавиться от основного заболевания. Зачастую лечение предполагает использование психотерапии, а также лекарственных препаратов. В редких случаях пациенту может потребоваться хирургическое вмешательство.
Обратившись в МХЦ сети «Открытая клиника», вы получаете квалифицированную помощь при любых заболеваниях сердечно-сосудистой системы. На новейшем оборудовании мы проведем вам все необходимые исследования, проконсультируем по любым вопросам и назначим лечение. После прохождения терапии в нашем центре вы забудете о тахикардии сердца.
Другие заболевания, которые мы лечим:
- Невроз сердца
- Шумы в сердце,
- Аритмия сердца,
- Ишемическая болезнь сердца,
- Хроническая ишемическая болезнь сердца,
- Гипертрофия сердца,
- Блокада сердца,
- Пороки сердца,
- Приобретенные пороки сердца,
- Нарушение ритма сердца,