Адреномиметики составляют большую группу фармакологических препаратов, которые оказывают стимулирующее действие на адренорецепторы, расположенные во внутренних органах и стенках сосудов. Эффект от их влияния определяется возбуждением соответствующих белковых молекул, что вызывает изменение метаболизма и функционирования органов и систем.
Адренорецепторы имеются во всех тканях организма, они представляют собой специфические белковые молекулы на поверхности мембран клеток. Воздействие на адренорецепторы адреналина и норадреналина (естественных катехоламинов организма) вызывает самые разные терапевтические и даже токсические эффекты.
При адренергической стимуляции может происходить как спазм, так и расширение сосудов, расслабление гладкой мускулатуры или, наоборот
, сокращение поперечнополосатой. Адреномиметики изменяют секрецию слизи железистыми клетками, усиливают проводимость и возбудимость мышечных волокон и т. д.
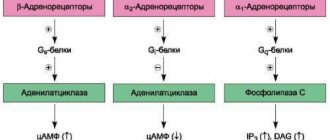
Эффекты, опосредованные действием адреномиметиков, очень разнообразны и зависят от вида рецептора, который в конкретном случае стимулируется. В организме представлены α-1, α-2, β-1, β-2, β-3 рецепторы. Влияние и взаимодействие адреналина и норадреналина с каждой из этих молекул представляют собой сложные биохимические механизмы, на которых мы не будем останавливаться, уточнив лишь наиболее важные эффекты от стимуляции конкретных адренорецепторов.
Рецепторы α1 расположены преимущественно на мелких сосудах артериального типа (артериолах), а стимуляция их приводит к сосудистому спазму, уменьшению проницаемости стенок капилляров. Результатом действия препаратов, стимулирующих эти белки, становится повышение артериального давления, уменьшение отека и интенсивности воспалительной реакции.
α2-рецепторы имеют несколько иное значение. Они чувствительны и к адреналину, и к норадреналину, но соединение их с медиатором вызывает обратный эффект, то есть, связавшись с рецептором, адреналин вызывает уменьшение собственной секреции. Воздействие на молекулы α2 приводит к уменьшению артериального давления, расширению сосудов, усилению их проницаемости.
Преимущественной локализацией β1–адренорецепторов считается сердце, поэтому и эффект от их стимуляции будет состоять в изменении его работы – усиление сокращений, возрастание пульса, ускорение проводимости по нервным волокнам миокарда. Результатом β1-стимуляции также будет увеличение артериального давления. Кроме сердца, рецепторы β1 расположены в почках.
β2-адренорецепторы имеются в бронхах, а активация их вызывает расширение бронхиального дерева и снятие спазма. β3-рецепторы присутствуют в жировой ткани, способствуют распаду жира с выделением энергии и тепла.
Выделяют разные группы адреномиметиков:
альфа- и бета-адреномиметики, препараты смешанного действия, селективные и неселективные.
Адреномиметики способны сами связываться с рецепторами, полностью воспроизводя эффект от эндогенных медиаторов (адреналин, норадреналин) – препараты прямого действия. В других случаях лекарство действует опосредованно: усиливает выработку естественных медиаторов, препятствует их разрушению и обратному захвату, что способствует повышению концентрации медиатора на нервных окончаниях и усилению его эффектов (непрямое действие).
Показаниями к назначению адреномиметиков могут стать:
- Острая сердечная недостаточность, шок, внезапное падение артериального давления, остановка сердца;
- Бронхиальная астма и другие заболевания дыхательной системы, сопровождающиеся бронхоспазмом; острые воспалительные процессы слизистой носа и глаз, глаукома;
- Гипогликемическая кома;
- Проведение местной анестезии.
Введение
Глаукома является наиболее распространенной причиной необратимого снижения зрения [1]. По мере развития офтальмологии понимание патогенеза глаукомы эволюционировало от снижения зрения, ассоциированного с повышением внутриглазного давления (ВГД), к развитию оптической нейропатии. В рамках современной концепции ключевым фактором патогенеза глаукомы является апоптоз ганглиозных клеток сетчатки (ГКС). На сегодняшний день единственным модифицируемым фактором риска развития глаукомы остается снижение ВГД (непрямая нейропротекция) [2]. Однако, по данным ряда исследований, в частности CNTGS (Collaborative Normal Tension Glaucoma Study; 160 глаз, рандомизированных в группы лечения и контроля), часть пациентов с глаукомой, несмотря на эффективный контроль ВГД, продолжают терять зрение [3]. Вследствие этого факта все чаще высказывается предположение о важной роли в развитии глаукомы факторов риска, не зависящих от ВГД. Непосредственное медикаментозное воздействие на механизм апоптоза ГКС является прямой нейропротекцией.
Структурное и функциональное поражение при глаукоме
При развитии глаукомы поражение зрительных функций ассоциируется с поражением комплекса ГКС [4], поражение фоторецепторов при глаукоме не было подтверждено [5]. Основным механизмом гибели ГКС является эксайтотоксичность (англ. to excite — возбуждать, активировать) — патологический процесс, ведущий к повреждению и гибели нервных клеток под воздействием нейромедиаторов, способных гиперактивировать NMDA- и AMPA-рецепторы (N-метил-D-аспартат; α-амино-3-гидрокси-5-метил-4-изо- ксазолпропионовая кислота). Впервые эксайтотоксичность была описана Lucas в эксперименте на мышах в 1957 г. [6], а в 1996 г. Dreyer показал повышение уровня глутамата в стекловидном теле больных с глаукомой [7]. Возникающее при эксайтотоксичности излишнее поступление ионов кальция в клетку активирует ряд ферментов (фосфолипаз, эндонуклеаз, протеаз), разрушающих цитозольные структуры и инициирующих апоптоз. Наиболее ярким примером эндогенного эксайтотоксина является глутамат (соль глутаминовой кислоты) — самый распространенный возбуждающий нейротрансмиттер в нервной системе позвоночных. Все больше данных указывают на то, что нейродегенерация сетчатки вследствие эксайтотоксичности глутамата и/или вызываемого им окислительного стресса связана с дисфункцией митохондриальной ДНК (мтДНК) [8–10]. Однако молекулярные механизмы, лежащие в основе этих эффектов, еще недостаточно изучены. В I триместре беременности аксоны ГКС находят свой путь к таламусу (у приматов — к среднему мозгу) благодаря экспрессии определенных генов [11], электрическим импульсам [12] и влиянию глии [13]. Не достигшие своей цели аксоны подвергаются апоптозу [14], достигшие же под воздействием нейротрофинов формируют в таламусе проекцию их топографического взаиморасположения. Благодаря такому тесному взаимодействию гибель конкретного аксона при глаукомной нейропатии сопровождается гибелью соседних ГКС [15]. Таким образом, исходное количество ГКС определяется выжившими в процессе эмбриогенеза клетками. Сравнительно большее количество ГКС могло бы отсрочить появление клинических признаков глаукомы, однако это преимущество нивелируется более выраженной реакцией на подъем ВГД в больших дисках зрительного нерва, ассоциированных с бщльшим объемом ГКС [16]. Европейское руководство по глаукоме 2014 г. описывает динамику изменения количества ГКС как основной критерий для определения принципов лечения глаукомы: в здоровых глазах без глаукомы при естественной возрастной убыли ГКС их количество никогда не снижается до уровня, при котором происходит значимое ухудшение зрения. При ускоренной гибели ГКС, характерной для глаукомы, их критически низкий уровень достигается в течение жизни, приводя сначала к дефектам поля зрения и затем к слепоте [17]. Изменения полей зрения у больных глаукомой являются классическим примером ассоциации структурного (секторальные поражения слоя нервных волокон) и функционального поражения глаза. Современные методы исследования позволяют заново осмыслить классическую триаду Грефе, более полно изучив взаимосвязь между ростом ВГД, изменением полей зрения и поражением ГКС [18, 19]. Снижение светочувствительности сетчатки и появление выпадений поля зрения, наблюдаемых на статической периметрии, коррелирует с истончением ГКС и слоя нервных волокон сетчатки (коэффициент детерминации при регрессионном анализе R2 составляет 0,303 и 0,406 соответственно), верифицируемых при оптической когерентной томографии [20]. Относительный риск (отношение риска события в одной группе относительно риска в другой группе) развития дефектов полей зрения при прогрессирующем истончении слоя нервных волокон сетчатки при использовании различных методов оценки составляет 3,95–8,44 (при использовании критериев Early Manifest Glaucoma Trial) [21]. Скорость прогрессирования растет на 0,02% в год на каждый децибел снижения светочувствительности [22]. Особенности поражения сетчатки при глаукоме — характерные аркуатные дефекты светочувствительности в центральной области и дефекты в нижненазальной области (наиболее снижающие качество жизни [23]) — используются при разработке алгоритмов тестовых программ для периметров и программ определения прогрессирования [19, 24]. Наличие псевдоэксфолиаций, больший возраст и большее среднее ВГД ассоциируются с более быстрым прогрессированием заболевания. Однако в выборке из 362 пациентов с динамикой ВГД в течение 7,8 года с 20,15 до 18,10 мм рт. ст. негативный тренд наблюдался в 89% случаев. При этом динамика снижения светочувствительности варьировала от -30,4 до +1,6 децибела в год, с пиками на -0,3 и -0,7 децибела в год [25]. Изменения зрительных функций значительно снижают качество жизни больных: при опросе 3700 больных с офтальмологическими заболеваниями пациенты с глаукомой оценили свое состояние на 62,6 балла из 100, что заметно ниже, чем при других распространенных заболеваниях глаз (78,1 балла при нарушениях рефракции, 74,4 — при катаракте, 72,7 — при ретинальной патологии) [26]. При тестировании по опроснику SF36 с дифференцированными шкалами у пациентов с глаукомой выявлена самая низкая категория жизненной активности (vitality), социальной активности и эмоционального состояния (social functioning, role-emotional functioning) [27]. Поражение бинокулярного зрения значимо влияет на качество жизни: потеря бинокулярной светочувствительности на 0,1 децибел в год увеличивает риск значимого снижения качества жизни почти на треть [28]; снижение бинокулярной светочувствительности на 1 децибел приводит к снижению качества жизни примерно на 2,8 балла из 100 (согласно результатам тестирования по опроснику NEI VFQ-25) [29]. При обобщении ряда исследований, посвященных качеству жизни у пациентов с глаукомой, становится ясно, что даже сам факт диагностирования неизлечимой болезни, потенциально приводящей к слепоте, может снизить качество жизни, а способность пациентов к самообслуживанию и сохранению привычной ежедневной активности прямо зависит от светочувствительности [30]. Исходя из вышесказанного современные руководства по глаукоме постулируют целью ее лечения сохранение зрительных функций путем предотвращения гибели ГКС [17, 31]. Задачами, требующими решения на пути к этой цели, являются нейропротекторное лечение (как опосредованное путем достижения целевого ВГД, так и прямое) и мониторинг полей зрения. Необходимо использовать программы порогового исследования поля зрения автоматических статических периметров (30–2 или 24–2 для Humphrey, G1 или G2 для Octopus); в надпороговых скрининговых режимах или при кинетической периметрии по Гольдману мелкие дефекты часто остаются невыявленными, теряясь среди границ изоптеров [32, 33]. Чтобы установить скорость гибели ГКС у пациентов с впервые выявленной глаукомой, Европейское глаукомное руководство предписывает проводить статическую периметрию по крайней мере трижды в первые два года; автоматические методы оценки прогрессирования (event analysis, trend analysis) требуют как минимум пять исследований для расчета. Определив стадию заболевания, скорость прогрессирования и целевое ВГД, при дальнейшем наблюдении возможно проводить статическую периметрию 2 раза в год или реже.
Показания к применению
Препараты β1-адреномиметиков используют при острой сердечной недостаточности, связанной с низким сердечным выбросом – на фоне инфаркта миокарда, кардиомиопатий, кардиогенном шоке, при операциях на сердце.
Препараты β2-адреномиметиков применяют при заболеваниях, связанных с бронхоспазмом – бронхиальной астме, хронической обструктивной болезни легких.
Также β2-адреномиметики назначают при угрозе преждевременных родов.
Препараты β3-адреномиметиков применяют при заболеваниях, связанных с повышенным тонусом мочевого пузыря – синдроме гиперактивного мочевого пузыря: недержании мочи, частых мочеиспусканиях.
Гипотензивное действие
Бримонидин является селективным альфа-2-адренергическим агонистом, совмещающим в себе опосредованное (путем снижения ВГД) и прямое нейропротекторное действие. Ингибирование аденилатциклазы агонистами альфа-2-адренергических рецепторов снижает продукцию циклического AMФ и, соответственно, продукцию внутриглазной жидкости цилиарным телом. Как и другие селективные агонисты адренергических рецепторов, бримонидин оказывает быстрое гипотензивное действие, наступающее в течение 20 мин после инстилляции и достигающее максимума в течение 1–2 ч. Вероятнее всего, быстрота снижения офтальмотонуса обусловлена сужением кровеносных сосудов цилиарного тела с последующим уменьшением его объема и снижением секреции внутриглазной жидкости [34]. Впоследствии сосудосуживающее действие препарата постепенно ослабевает и кровоток восстанавливается. Длительный гипотензивный эффект препарата обусловлен увеличением увеосклерального оттока, развивающегося параллельно с восстановлением кровотока и продукции внутриглазной жидкости [35]. Наряду с более высокой селективностью бримонидин обладает меньшей липофильностью, чем другие препараты его фармакологической группы. Это свойство препятствует его диффузии через эпителиальный барьер роговицы и конъюнктивы, а также системному всасыванию через кровоток, что предотвращает возникновение спектра побочных явлений, наблюдающихся, например, у более липофильного клонидина [36]. Бримонидин был запатентован в 1972 г. и представлен для широкого использования в офтальмологии в 1996 г. Во время преклинических испытаний на кроликах, обезьянах и крысах была выявлена его высокая селективность: связывание с альфа-2-адренорецепторами в 1000 раз превышает связывание с альфа-1-адренорецепторами, что позволяет минимизировать его влияние на сердечно-сосудистую и респираторную системы. Его селективность к альфа-2-рецепторам была в 7–12 раз выше, чем у клонидина. Кроме того, в отличие от аналогов, бримонидин не вызывает мидриаз [37]. По результатам исследования гипотензивного эффекта и побочных явлений бримонидина в концентрациях 0,08, 0,2, и 0,5% (194 пациентов) оптимальной с точки зрения переносимости и гипотензивного потенциала была признана дозировка бримонидина 0,2% [38]. При сравнении эффективности бримонидина 0,2% и тимолола 0,5% в двух независимых исследованиях (всего 1300 пациентов) оба лекарства показали удовлетворительную и сопоставимую гипотензивную эффективность и переносимость при разной выраженности побочных реакций — более частых аллергических проявлениях при использовании бримонидина, и выраженном снижении ЧСС в группе использования тимолола. Применение бримонидина сопровождалось более выраженным пиковым снижением ВГД, тимолол же обладал более низкой фазой плато [39, 40]. При назначении бримонидина пациентам с декомпенсированным ВГД на максимальном гипотензивном режиме офтальмотонус снижался на 16–32%, у 80% испытуемых уровень компенсации ВГД сохранялся через 6 мес. при хорошей переносимости препарата [41]. В ряде публикаций отмечается тропность бримонидина к меланину. Высказывалось предположение, что меланин выступает резервуаром для бримонидина, накапливая его, а затем высвобождая в окружающие ткани. В сравнительном исследовании пигментированных кроликов и альбиносов была подтверждена различная скорость накопления препарата [42]. Установлено, что бримонидин аккумулируется в радужке, цилиарном теле и хориоретинальном комплексе даже после однократного закапывания. Таким образом, эффект аккумулирования потенцируется со временем, позволяя за несколько недель повысить концентрацию препарата в указанных структурах в 17 раз. Эта способность к накоплению также позволяет предположить, что местная терапия бримонидином может создавать в заднем отрезке глаза концентрацию, достаточную для нейропротекторного воздействия [36, 43]. Примером этого воздействия являются результаты исследования 2011 г., в ходе которого 190 пациентам с глаукомой нормального давления, получавшим тимолол или бримонидин, каждые 4 мес. выполняли периметрию. Были получены данные, показывающие, что на длительных сроках наблюдения (до 48 мес.) количество пациентов с ухудшением полей зрения в 4 раза выше при использовании монотерапии тимололом, чем при назначении бримонидина [44]. Ранее были проведены исследования, в ходе которых у пациентов с открытоугольной глаукомой было показано улучшение контрастной чувствительности после 3 мес. терапии бримонидином [45], а также улучшение светочувствительности сетчатки при использовании бримонидина [46]. В другой работе была отмечена тенденция замедления ухудшения полей зрения у пациентов с дистрофией сетчатки, получавших бримонидин более 24 мес. [47].
Неселективные адреномиметики
Адреномиметики неселективного действия способны возбуждать и альфа-, и бета-рецепторы, вызывая широкий спектр изменений во многих органах и тканях. К ним относятся адреналин и норадреналин.
Адреналин активирует все виды адренорецепторов,
но считается преимущественно бета-агонистом. Его основные эффекты:
- Сужение сосудов кожи, слизистых оболочек, органов брюшной полости и увеличение просветов сосудов мозга, сердца и мышц;
- Повышение сократительной способности миокарда и частоты сокращений сердца;
- Расширение просветов бронхов, уменьшение образования слизи бронхиальными железами, снижение отека.
Адреналин применяется в основном в целях оказания скорой и неотложной помощи при острых аллергических реакциях, в том числе, анафилактическом шоке, при остановке сердца (внутрисердечно), гипогликемической коме. Адреналин добавляют к анестезирующим препаратам для увеличения длительности их действия.
Эффекты норадреналина во многом схожи с адреналином, но меньше выражены.
Оба средства одинаково влияют на гладкую мускулатуру внутренних органов и обмен веществ. Норадреналин повышает сократимость миокарда, сужает сосуды и увеличивает давление, но частота сердечных сокращений может даже уменьшиться, что обусловлено активацией других рецепторов клеток сердца.
Основное применение норадреналина ограничивается необходимостью подъема артериального давления в случае шока, травмы, отравления. Однако следует быть осторожными из-за риска гипотонии, почечной недостаточности при неадекватном дозировании, некроза кожи в месте введения вследствие сужения мелких сосудов микроциркуляторного русла.