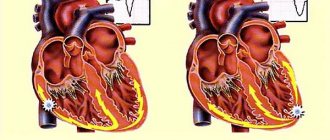
Медицинские технологии достигли настолько высокого уровня, что сегодня хирурги умеют проводить даже операции по пересадке сердца. Только вот донорских органов очень мало, из-за чего нуждающиеся в них пациенты вынуждены подолгу ждать их появления и иногда не доживают до этого момента. Для увеличения шансов на жизнь, хирурги часто пересаживают людям искусственные органы: инженеры уже придумали механические версии ушей, глаз, почек и других жизненно важных частей тела. Одним из самых сложных органов в человеческом организме является сердце, необходимое для обеспечения органов кровью, богатой кислородом и питательными веществами. Искусственное сердце уже существует и недавно французская компания Carmat выпустила его новую версию. Она оснащена биологическими клапанами, благодаря которым у человека с меньшей долей вероятности возникают осложнения, а сам аппарат работает гораздо тише. Это важное достижение в области медицины, поэтому давайте изучим конструкцию искусственного сердца подробнее.
Искусственное сердце от французской компании Carmat
Искусственное сердце: классика и инновации
22 августа 2021 года исполняется 98 лет со дня рождения Дентона Кули, человека, впервые пересадившего пациенту искусственное сердце, и 49 лет со дня самой операции. Что изменилось в кардиотрансплантологии за последние полвека?
Что такое «искусственное сердце»
Искусственным сердцем сегодня называют два довольно разных типа аппаратов. Оба они, разумеется, выполняют насосную функцию, «качая» кровь по человеческому телу. Однако аппараты первого типа — так называемые АИКи (аппарат искусственного кровообращения) — это большие машины, используемые во время операций на сердце. Фактически они представляют собой комплекс «сердце-легкие», так как состоят из собственно насоса, качающего кровь, и оксигенатора, снабжающего эту кровь кислородом.
Второй тип — это кардиопротез, т. е. такое устройство, которое может выполнять функции сердца после имплантации в организм человека. Именно такой аппарат был впервые пересажен больному в 1969 году Дентоном Кули — как временная мера, пока пациент дожидается подходящего донорского сердца. Тогда пациент прожил после операции 65 часов — и это уже был успех.
Главные проблемы
Сложностей в таком деле, как конструирование искусственного органа, конечно, немало. Но среди них можно выделить две основных проблемы. Первая — это источники энергии: сердце-то внутри, а батарейки должны быть снаружи, чтобы их можно было менять без привлечения хирургической бригады.
Провод, соединяющий батарею и механизм, служит отличной «дорогой» для патогенных микроорганизмов, вызывающих разного рода инфекции. Кроме того, сами батарейки очень крупные — целый рюкзак на спине больного, с которым приходится быть неразлучным.
Вторая — это тромбообразование. Даже пациентам, у которых всего один синтетический клапан в родном биологическом сердце, приходится пожизненно принимать лекарства, снижающие свертываемость (варфарин, ривароксабан). Когда же всё сердце синтетическое, вероятность тромботических осложнений возрастает в десятки раз.
Полностью эта проблема сейчас не решена, но существует компромиссное решение: искусственные сердца выбрасывают кровь не толчками, как «природные», а сплошным непрерывным потоком. В таком потоке отсутствуют турбулентные завихрения, и тромбы образуются заметно реже.
Сам себе батарейка
От проводов, идущих снаружи внутрь, пока избавиться не удается, хотя идеи на этот счет имеются очень интересные. Например, была попытка организации подзарядки непосредственно через кожу пациента. Однако разность потенциалов приводит к развитию сильных дерматитов. Для решения этой проблемы сейчас разрабатывают специальные защитные гели (которые одновременно могут улучшать проводниковые свойства кожи).
А вот для того, чтобы избавиться от тяжелого рюкзака с аккумуляторами, изобретатели предложили весьма изящное решение. Пациент надевает на ногу специальный экзопротез (внешне он похож на ортезы, которые носят люди с травмированным коленом), в который вмонтирован генератор.
Во время ходьбы механическая энергия трансформируется в электричество, которое и обеспечивает работу механического сердца. Можно сказать, что Жванецкий в своей старой миниатюре предсказал появление этого устройства — когда предлагал прицепить к балерине динамо-машину для выработки электричества.
Из материала заказчика
Не отстают и биотехнологии — в частности, выращивание органов из стволовых клеток пациента. У сердца есть одно преимущество перед многими другими органами: в нем не так много различных типов клеток. Но, с другой стороны, сложность в том, что основная масса клеток сердца — сократительные кардиомиоциты — должна быть расположена в одном направлении. Ведь, синхронно сокращаясь, они должны вызывать одно мощное движение, а не картину «лебедь, рак и щука».
Как работает сердце?
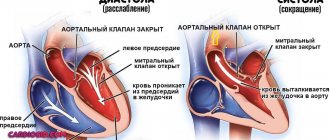
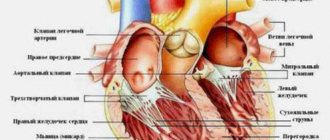
Сразу же отмечу, что мы рассмотрим работу искусственного сердца вкратце, потому что это очень сложный орган и для объяснения всех принципов нужно написать целую книгу. По данным издания Interesting Engineering, имплант почти полностью имитирует работу настоящего сердца. Этот орган качает кровь за счет сокращения четырех разных камер: левого предсердия, правого предсердия, левого желудочка и правого желудочка. У здоровых людей один цикл (удар) состоит из трех коротких этапов:
- наполнения предсердия, при котором кровь из крупных вен наполняет предсердия (0,10 секунд);
- сокращения желудочков, при котором кровь отправляется в органы (0,32 секунды);
- перерыва, при котором сердце отдыхает (0,4 секунды).
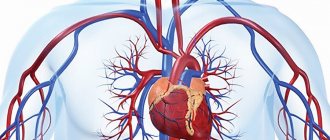
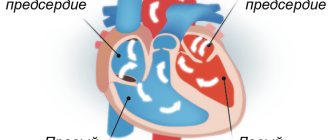
Правый желудочек и левое предсердие отвечают за малый круг кровообращения. По малому кругу бедная кислородом венозная кровь течет из правого желудочка сердца по легочным артериям к легким и обогащается кислородом. Так из венозной она превращается в артериальную и по легочным венам отправляется в левое предсердие.
Строение человеческого сердца
Левый желудочек и правое предсердие отвечают за большой круг кровообращения. Этот круг необходим для кровоснабжения всех органов организма человека, в том числе легких.
Большой и малый круг кровообращения человека
Опять же отмечу, что это очень краткое описание. Если хотите разобраться, как именно работает сердце, лучше посмотрите это видео. Но сначала рассмотрим искусственное сердце от компании Carmat.
Публикации в СМИ
МЕХАНИЧЕСКИЕ ПРОТЕЗЫ
• Виды механических протезов •• Шаровые (в настоящее время не применяют): Magovern-Cromie, Smeloff-Cutter, Cross-Jones, АКЧ, МКЧ •• Дисковые: Bjork-Shiley, Sorin Monocast, Medtronic-Hall, Lillehei-Kaster, Omniscience, Bicer, МИКС, ЛИКС •• Двустворчатые: St. Jude Medical, Sorin Bi Carbon, Carbomedics, ATS, Duromedics, MedEng.
• Преимущество •• Долговечность — в среднем более 30 лет (не принимая во внимание случаи протезного инфекционного эндокардита [ИЭ]) •• Исключение составляют поломки стойки запирательного элемента в некоторых моделях клапана Bjork–Shiley.
• Недостатки •• Тромбогенность (наименьшая у клапана St. Jude Medical) •• Необходимость постоянной антикоагулянтной терапии •• Относительное стенозирование у дисковых и шаровых протезов •• Постпротезные аневризмы у дисковых протезов с небольшим углом открытия запирательного элемента.
• Антикоагулянтная терапия •• Начинают через 2 сут после операции, несмотря на терапию непрямыми антикоагулянтами (МНО на уровне 3,0–4,5) •• Риск тромбоэмболий высок (0,2% летальных и 2% нелетальных осложнений в год) •• Тромбозы после протезирования митрального клапана возникают значительно чаще, вследствие протезирования аортального клапана •• Неоднозначное отношение к механическим клапанам в трикуспидальной позиции (как правило, используют протезы St. Jude Medical) вызвано частым тромбообразованием в правых отделах сердца ••• Такое тромбообразование обусловлено, по-видимому, низкой концентрацией ПгI2, обладающего антитромботическим действием. Этот Пг синтезируется в лёгких и поступает с током крови в левые отделы сердца •• Если хотя бы один раз возникла тромбоэмболия, вызванная наличием протеза, то риск повторных эмболий повышен •• Постоянная антикоагулянтная терапия, даже при умеренном увеличении МНО (до 3,0), значительно увеличивает риск кровотечений.
БИОЛОГИЧЕСКИЕ КСЕНОПРОТЕЗЫ (Hancock, Carpentier-Edwards, КемКор) и аллотрансплантаты. По гемодинамическим характеристикам оба клапана сопоставимы с низкопрофильными механическими протезами (двустворчатым и дисковым).
• Преимущества •• Тромбогенность существенно ниже, чем у механических протезов •• Антикоагулянтная терапия необходима только в течение 2–3 мес после операции (пока не произойдёт эндотелизация пришивного кольца).
• Недостатки •• Недолговечность вследствие дегенеративных изменений и ИЭ, обычно проявляющихся через 4–5 лет после операции и в дальнейшем прогрессирующих •• Вероятность дисфункции через 10 лет после операции — 20%, через 15 лет — 50% •• Долговечность аллотрансплантатов незначительно выше, чем других биологических протезов.
• Факторы, влияющие на долговечность •• Возраст пациента — вероятность дисфункции протеза обратно пропорциональна возрасту на момент операции •• Позиция — вероятность дисфункции протеза в митральной позиции ниже, чем в аортальной •• ХПН и гиперкальциемия при гиперпаратиреозе — увеличение риска дисфункции и скорости её прогрессирования •• Беременность — укорочение срока службы вследствие большей гемодинамической нагрузки (объёмом).
Выбор протеза • Механические протезы •• Аортальная позиция или необходимость одновременного протезирования митрального и аортального клапанов •• ИЭ или реимплантация протеза в связи с ИЭ •• Гиперкальциемия •• Почечная недостаточность • Биологические протезы •• Высокий риск тромбозов (см. ниже) •• Противопоказания к антикоагулянтной терапии (геморрагические диатезы, повторные желудочно-кишечные кровотечения, алкоголизм, нежелание или неспособность следовать схеме лечения), планируемая беременность, возраст старше 65-70 лет, протезирование ТК (даже при одновременной имплантации механического протеза в митральной или аортальной позиции).
Осложнения • Относительный стеноз протеза (допустимые показатели градиентов давления на протезах указаны в технической документации к ним) • Обструкция протеза при тромбозе, фиброзе, разрастании вегетаций • Клапанная (тромбоз протеза или вегетации) или околоклапанная (абсцесс кольца, отрыв протеза) регургитация • ИЭ •• Протезный ИЭ ••• Распространённость — 1–4% в год ••• Ранний (раньше чем через 90 сут после операции) и поздний инфекционный эндокардит бывает вызван разными возбудителями ••• ИЭ различают по клиническому течению и осложнениям ••• При инфекции механического протеза поражение самого клапана возникает редко, но существует тенденция к вовлечению в процесс биологического материала, покрывающего пришивное кольцо ••• При инфицировании биологического протеза возникает поражение как створок, так и клапанного кольца. Вегетации могут не визуализироваться при ЭхоКГ ••• Регургитация возникает вследствие разрушения или перфорации створок биологического протеза, механического препятствия нормальному движению шарика или диска, создаваемого вегетациями •••• Околоклапанная регургитация возникает вследствие абсцесса клапанного кольца и несостоятельности швов ••• Обструкция клапана чаще возникает в связи с массивными вегетациями (причины — грибы, Haemophilus parainfluenzae) •••• Обструкция биологического протеза вегетациями чаще происходит в митральной, чем в аортальной позиции ••• Инфекция протезов сравнительно плохо поддаётся антибиотикотерапии, чаще всего необходимо репротезирование ••• Лечение ИЭ — см. Эндокардит инфекционный.
Оценка состояния протезов • При аускультации слышны щелчки открытия (обычно более тихие) и закрытия (как правило, более громкие) механических протезов; их исчезновение или уменьшение интенсивности — признак тромбоза • Над дисковыми протезами может выслушиваться нежный мезосистолический шум • Биологические протезы не дают специфической аускультативной картины • Рентгенологическое исследование в настоящее время практически не применяют специально для исследования состояния протезов • При ЭхоКГ выясняют тип протеза, измеряют диаметр и амплитуду открытия запирательного элемента механического протеза, измеряют градиент давления на протезе и диагностируют наличие патологических потоков, вегетаций, тромбоза, фиброза • Чреспищеводную ЭхоКГ для визуализации тромбов и вегетаций проводят при подозрении на дисфункцию протеза или при фибрилляции/трепетании предсердий • Инвазивные методы диагностики показаны только при затруднениях в диагностике.
Антикоагулянтная терапия • При внесердечных операциях, чреватых большой кровопотерей, за 2–4 сут до вмешательства отменяют антикоагулянты, 1 раз в 2 сут определяют МНО • За сутки до операции (или раньше, если МНО снижается значительно) начинают вводить гепарин в/в • За несколько часов до операции отменяют гепарин • После отмены гепарина назначают низкомолекулярный декстран, его инфузию продолжают и в послеоперационном периоде до возобновления терапии гепарином и варфарином • Терапию гепарином и непрямыми антикоагулянтами возобновляют через 1–2 сут после операции.
РЕКОМЕНДАЦИИ ПО ДОЗИРОВКЕ НЕПРЯМЫХ АНТИКОАГУЛЯНТОВ АНТИТРОМБОТИЧЕСКОЙ ТЕРАПИИ у пациентов с протезированными клапанами сердца.
• Показания •• Первые 3 мес после имплантации — варфарин, МHO=2,5–3,5 •• Более 3 мес после имплантации ••• Механические клапаны •••• Аортальная имплантация без факторов риска: двустворчатые клапаны (варфарин, МHO=2,0–3,0); дисковые клапаны (варфарин, МHO=2,5–3,5); аортальная имплантация в сочетании с факторами риска (варфарин, МHO=2,5–3,5) •••• Митральная имплантация (варфарин, MHO=2,5–3,5) ••• Биологические клапаны •••• Аортальная имплантация без факторов риска (ацетилсалициловая кислота по 80–100 мг/день) •••• Аортальная имплантация в сочетании с факторами риска (варфарин, MHO=2,0–3,0) •••• Митральная имплантация без факторов риска (ацетилсалициловая кислота по 80–100 мг/день) •••• Митральная имплантация в сочетании с факторами риска (варфарин, MHO=2,5–3,5) ••• Одномоментное коронарное шунтирование — добавление ацетилсалициловой кислоты 80–100 мг/день ••• Варфарин, MHO=3,5-4,5 у пациентов с высоким риском, когда ацетилсалициловая кислота не может быть назначена.
• Если у пациента на адекватной антикоагулянтной терапии произошёл тромбоэмболический эпизод, дозировку препаратов следует откорректировать по следующей схеме •• Варфарин, MHO=2,0–3,0 — дозу варфарина увеличивают до достижения MHO=2,5–3,5 •• Варфарин, MHO=2,5-3,5 — доза может быть увеличена до достижения MHO=3,5-4,5.
• Доказанные лекарственные взаимодействия с варфарином •• Препараты, усиливающие эффект варфарина: амиодарон, ципрофлоксацин, ко-тримоксазол, дисульфирам, флуконазол, циметидин, клофибрат, эритромицин, метронидазол, сульфинпиразон •• Препараты, уменьшающие эффект варфарина: барбитураты, карбамазепин, гризеофульвин, рифампицин, менадиона натрия бисульфит.
Осложнения • Эмболии артерий большого круга • Тромбоз протеза •• При тромбозе механического протеза применение тромболитиков и гепарина в большинстве случаев позволяет устранить обструкцию, по крайней мере, частично •• Эффективность тромболизиса контролируют с помощью ЭхоКГ •• При высоком риске кровотечений и выраженных нарушениях гемодинамики предпочтительнее хирургическое лечение (тромбэктомия или репротезирование клапана) •• Если тромб образуется на вегетациях или разросшейся соединительной ткани, тромболизис малоэффективен или не эффективен совсем •• Окончательные рекомендации по применению тромболизиса как альтернативы хирургическому лечению ещё не разработаны • Тяжёлые кровотечения •• Возникают часто, даже при тщательно контролируемом, терапевтическом уровне гипокоагуляции •• При длительной антикоагулянтной терапии временное уменьшение дозы или полное устранение гипокоагуляции больные обычно переносят хорошо •• Для активного устранения гипокоагуляции вводят менадиона натрия бисульфит (5–10 мг в/в), свежезамороженную плазму (1–2 дозы), устраняют причину кровотечения (с помощью эндоскопического, эндоваскулярного или хирургического вмешательства) и возобновляют антикоагулянтную терапию.
Сокращения • ИЭ — инфекционный эндокардит
Что может препятствовать проведению операции
К сожалению, далеко не каждый пациент сможет получить донорское сердце. Этому есть множество различных причин:
- Очень небольшое количество доноров. Им может стать только то лицо, у которого зарегистрирована смерть головного мозга, а сердце абсолютно здорово.
- На получение данного органа очень большая очередь (лист ожидания), наиболее актуально это для детей. Орган должен полностью соответствовать всем заявленным требованиям и, возможно, такие параметры будут еще у нескольких десятков больных, стоящих гораздо раньше в списке.
- Иногда донорский орган невозможно доставить в нужное место вовремя, так как операцию нужно провести не позже, чем через шесть часов после изъятия.
- Многие не соглашаются на проведение пересадки по этическим или религиозным понятиям. Например, в христианстве человек жив, пока бьется его сердце.
- Пациента может остановить страх перед длительной и довольно дорогой реабилитацией.
- Преклонный возраст. Обычно операции не проводят людям после 60 лет, но бывают и исключения.
Кроме перечисленных препятствий, пересадку не будут проводить при ряде других, не относящихся к кардиологии, болезней. Это могут быть:
- легочная гипертензия в тяжелой форме;
- сахарный диабет в стадии, при которой уже начались негативные изменения сетчатки глаз, в сосудах или почках;
- инфекционные заболевания в острой стадии;
- ВИЧ и туберкулез;
- аутоиммунные болезни – ревматизм, артрит, красная волчанка и т. д.;
- печеночная или почечная недостаточность в тяжелой форме;
- хронические тяжелые формы заболевания легких;
- онкология;
- зависимость от алкоголя или наркотиков;
- тяжелые психические расстройства.
Искусственное сердце – противопоказания к проведению операции
Можно выделить ряд состояний, при которых пересадка искусственного желудочка невозможна или должна быть отложена:
- Инфекционные заболевания;
- Тяжела почечная, легочная, печеночная патология;
- Нарушения в свертывающей системе крови, например, гемофилия.
Оперирующие хирурги–кардиологи Израиля обладают большим опытом в проведении имплантации искусственных желудочков. Этот способ коррекции сердечной недостаточности ежегодно спасает жизнь тысячам пациентах.
Внимание все поля формы обязательны. Иначе мы не получим вашу информацию. Альтернативно пользуйтесь
Неинвазивная вентиляция легких
За последние два десятилетия заметно возросло использование оборудования неинвазивной искусственной вентиляции легких. НИВЛ стала общепризнанным и широко распространенным инструментом терапии острой и хронической дыхательной недостаточности как в лечебном учреждении, так и в домашних условиях.
Одним из ведущих производителей медицинских респираторных устройств является австралийская компания ResMed
НИВЛ — что это?
Неинвазивная вентиляция легких относится к искусственной респираторной поддержке без инвазивного доступа (т.е. без эндотрахеальной или трахеостомической трубки) с использованием различных известных вспомогательных режимов вентиляции.
Оборудование подает воздух в интерфейс пациента через дыхательный контур. Для обеспечения НИВЛ используются различные интерфейсы – носовая или рото-носовая маска, шлем, мундштук. В отличие от инвазивного метода, человек продолжает дышать самостоятельно, но получает аппаратную поддержку на вдохе.
Когда применяется неинвазивная вентиляция легких?
Ключом к успешному использованию неинвазивной вентиляции легких является признание ее возможностей и ограничений, а также тщательный отбор пациентов (уточнение диагноза и оценка состояния больного). Показаниями для НИВЛ являются следующие критерии:
- одышка в состоянии покоя;
- частота дыхания ЧД>25, участие в респираторном процессе вспомогательной дыхательной мускулатуры;
- гиперкапния (PaC02>45 и его стремительное нарастание);
- уровень Ph
- симптоматическое отсутствие положительного эффекта от кислородотерапии, гипоксемия и расстройства газообмена;
- повышение сопротивления дыхательных путей в 1,5-2 раза от нормы.
Для проведения неинвазивной вентиляции пациент должен пребывать в сознании и быть в состоянии выполнять указания врачей. Должна быть ясная перспектива стабилизации больного в течение нескольких часов или суток после начала респираторной поддержки. Абсолютными противопоказаниями для НИВЛ являются:
- кома;
- остановка сердца;
- остановка дыхания;
- любое состояние, требующее немедленной интубации.
Преимущества НИВЛ
Одним из преимуществ неинвазивной вентиляции легких является возможность проведения терапии в домашних условиях
Неинвазивная вентиляция легких позволяет помочь больному с острой или хронической дыхательной недостаточностью, не прибегая к эндотрахеальной интубации или к трахеостомии. Методика является более простой и комфортной для пациента. Перечислим основные преимущества НИВЛ.
- Сеанс респираторной поддержки легко начать и так же просто завершить.
- Пациент сохраняет способность говорить, глотать, самостоятельно принимать пищу, кашлять.
- Процедура не вызывает осложнений, возможных при эндотрахеальной интубации и трахеостомии, в числе которых механическое повреждение трубкой внутренних органов, кровотечение, отек голосовой щели, инфицирование дыхательных путей и т.д.
- Воздух проходит через дыхательные пути, за счет чего увлажняется, очищается и согревается естественным образом.
- НИВЛ можно проводить на ранней стадии заболевания, т.е. до того как состояние больного станет критическим. Это сокращает продолжительность лечения, уменьшает количество осложнений, а также снижает риск повторной госпитализации.
- Во многих случаях аппараты для неинвазивной респираторной поддержки могут использоваться не только в стационаре, но и в домашних условиях.
- После завершения лечения отсутствует период «отлучения от респиратора».
Неинвазивная ИВЛ в сознании имеет также некоторые недостатки и побочные эффекты. Например, невозможно применять высокое лечебное давление, т.к. это ведет к существенным утечкам из-под маски. Прямой доступ к дыхательным путям отсутствует, поэтому нельзя провести их санацию. Также нельзя не упомянуть вероятность аэрофагии, аспирации содержимого желудка и раздражение кожи в местах прилегания контура.
Неинвазивная вентиляция в режимах СИПАП и БИПАП
Термины СИПАП и БИПАП зачастую употребляются как синонимы к НИВЛ. Это распространенные методы неинвазивной респираторной поддержки с использованием специальных портативных устройств. Опцию СИПАП и БИПАП имеют многие современные аппараты ИВЛ, используемые в отделениях интенсивной терапии.
Портативные респираторы отличаются невысокой стоимостью (относительно реанимационных стационарных аппаратов ИВЛ), при этом они эффективно компенсируют даже высокую утечку воздуха. Но чаще всего они не предоставляют возможности расширенного мониторинга состояния пациента в режиме реального времени.
Большинство реанимационных респираторов могут работать в режиме СИПАП и БИПАП. Но чаще для респираторной поддержки пациента в сознании используются портативные аппараты.
В режиме СИПАП (continuous positive airway pressure) аппарат подает воздух под постоянным положительным давлением, дыхание пациента спонтанное (т.е. самостоятельное). К методу прибегают при ведении пациентов с синдромом обструктивного апноэ сна (СОАС) средне-тяжелой или тяжелой степени, а также с посттравматической или послеоперационной острой дыхательной недостаточностью.
БИПАП-аппараты (bi-level positive airway pressure) имеют более обширную область применения и различные варианты режимов. В отличие от СИПАП, они предполагают увеличение давления на вдохе и его уменьшение на выдохе. Благодаря этому появляется возможность использовать высокое лечебное давление, но при этом пациент не испытывает дискомфорт в фазе выдоха, преодолевая сопротивление воздушного потока. Двухуровневая вентиляция позволяет разгрузить дыхательные мышцы, уменьшить частоту дыхания и увеличить дыхательный объем. А наличие в современных моделях вспомогательных режимов помогает подобрать оптимальный протокол терапии в соответствии с диагнозом и потребностями больного.
СИПАП и БИПАП-аппараты для помощи пациентам с COVID-19
Последние несколько месяцев проблема искусственной вентиляции часто поднимается в связи с пандемией COVID-19. Высокий спрос на аппараты ИВЛ стал причиной их дефицита. Австралийская компания ResMed, являясь производителем медицинских респираторов, предпринимает необходимые меры, чтобы в приоритетном порядке наладить выпуск устройств для оказания помощи пациентам с дыхательной недостаточностью высокой степени тяжести. Но ввиду острой нехватки оборудования на данный момент для стабилизации больных ключевое значение приобретают альтернативные варианты вентиляции легких, в т.ч. неинвазивная респираторная поддержка.
Пандемия COVID-19 привела к дефициту аппаратов ИВЛ. В связи с этим первичная помощь пациентам с коронавирусной инфекцией и симптомами острой дыхательной недостаточности может проводиться на аппаратах СИПАП и БИПАП.
СИПАП и БИПАП-терапия может использоваться для оказания первичной помощи пациентам с COVID-19, нуждающимся в респираторной поддержке. В соответствии с клиническими протоколами и отчетами, полученными от клиницистов Италии и Китая, неинвазивная вентиляция (в т.ч. в режимах БИПАП и СИПАП) для пациентов с COVID-19 рекомендована при следующих сценариях.
- Для обеспечения респираторной поддержки пациентам с дыхательной недостаточностью, которые еще не перешли в более тяжелую гипоксемию.
- Для облегчения экстубации и восстановления после инвазивной вентиляции.
- Для сокращения пребывания пациентов в стационаре, предоставляя возможность больным, которые все еще нуждаются в респираторной поддержке и реабилитации, перейти на домашнее лечение.
НИВЛ не в состоянии заменить инвазивную вентиляцию в случае наиболее тяжелых форм COVID-19. Но данная терапия важна при сортировке больных в лечебно-профилактических учреждениях. СИПАП и БИПАП-аппараты обеспечивают дополнительную подачу кислорода в менее тяжелых случаях и уменьшают зависимость от инвазивных ИВЛ. Кроме того, они актуальны для стран, где коечная емкость больниц оказалось недостаточной в условиях развернувшейся пандемии.
Для терапии в домашних условиях подходят следующие устройства бренда ResMed: БИПАП-аппараты серии Lumis, а также сервовентилятор AirCurve 10 CS PaceWave. К ним можно подключить дополнительный кислород (до 15 л/мин), а также модуль с пульсоксиметрическим датчиком для мониторинга насыщения крови кислородом.
Длительное использование неинвазивной вентиляции легких: польза или вред
Существует мнение, что чем дольше пациент находится на аппарате ИВЛ, тем сложнее ему отказаться от респиратора. Это порождает страх «разучиться» дышать без аппарата и страх задохнуться, если аппарат по каким-то причинам отключится. Но подобные риски имеют место быть лишь при инвазивной вентиляции, когда аппарат в буквальном смысле дышит вместо пациента. В свою очередь, длительное использование неинвазивной вентиляции легких не вызывает привыкания, т.к. больной дышит самостоятельно, а медицинское оборудование лишь помогает ему в этом.
По результатам исследований, продолжительная неинвазивная респираторная поддержка (в т.ч. в домашних условиях) позволяет оптимизировать газообмен, снизить нагрузку на аппарат дыхания и уменьшить риск последующих госпитализаций у пациентов с ХОБЛ. Одно из преимуществ длительной НИВЛ – возможность обеспечить отдых дыхательной мускулатуре, которая находится в состоянии хронического переутомления.
Длительное использование неинвазивной вентиляции легких улучшает качество сна и самочувствие во время бодрствования. При отмене НИВЛ даже на неделю у пациентов с хронической дыхательной недостаточностью снова начинаются утренние мигрени, появляется одышка, также у них ухудшается ночная сатурация.
НИВЛ при хронической дыхательной недостаточностью чаще всего проводится в ночное время. Во-первых, это повышает общее время респираторной поддержки. Во-вторых, помогает устранить ночную гиповентияцию и эпизоды десатурации, которые чаще всего возникают в REM-фазе сна.
Подготовка пациента к операции
Трансплантация сердца – сложное вмешательство, требующее тщательной подготовки. Пациент проходит многоступенчатое обследование, прежде чем принимается решение о возможности пересадки органа. Необходимо:
- тщательно собрать анамнез заболевания;
- выполнить рентгенографию органов грудной клетки;
- пройти нагрузочный тест на максимальное потребление кислорода (VO2);
- сдать ряд анализов на инфекции для исключения гепатитов, ВИЧ и ряда других заболеваний, которые могут стать противопоказанием;
- сдать рутинные анализы мочи, крови для оценки общего состояния организма;
- пройти зондирование сердца с тонометрией правых отделов (необходимо, чтобы исключить легочную гипертензию, которая выступит противопоказанием к трансплантации);
- сдать анализ для оценки человеческого лимфоцитарного антигена (HLA);
- пройти ЭКГ, ЭхоКГ.
При обследовании могут быть выявлены как абсолютные, так и относительные противопоказания, исключающие постановку пациента в лист ожидания донорского сердца.
4.Риски при пересадке сердца
Основные риски операции по пересадке сердца включают в себя:
Отторжение донорского сердца.
Чтобы проверить организм пациента, хирурги регулярно проводят биопсию тканей сердца, а также эхокардиографию, электрокардиографию или анализ крови.
Если организм пациента отторгает сердце, то прописываются дополнительные лекарства (иммунодепрессанты или стероиды), которые подавляют иммунную систему, чтобы она приняла донорское сердце. У этих лекарств могут быть побочные эффекты, самые серьёзные из которых – различные инфекции и развитие рака.
Атеросклероз артерий, который мог появиться в донорском сердце
. Обычно это осложнение и одновременно — важный ограничительный фактор, который влияет на продолжительность жизни.
О чём стоит подумать
После пересадки сердца вы должны следовать строгим правилам жизни, в которые входит ежедневный приём лекарств и регулярный медицинский уход. Под медицинским уходом подразумевается постоянные анализы (биопсия) тканей пересаженного сердца в целях предотвращения отторжения.
Кандидаты на пересадку получают сердце в соответствии с датой постановки на учёт и серьёзностью заболевания. Также не стоит забывать о том, что количество донорских органов ограничено.