Home » Отделение кардиологии и кардиохирургии » Болезни » Аномалия Эбштейна
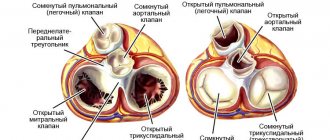
Аномалия Эбштейна– это достаточно редкий ВПС (врожденный порок сердца), который характеризуется смещением створок трехстворчатого (трикуспидального) клапана в полость правого желудочка. То есть створки патологически измененного клапана образуются из стенок правого желудочка (ПЖ), а не из предсердно-желудочкового (атрио-вентрикулярного) кольца, как в норме, при этом они смыкаются не полностью, поэтому развивается недостаточность трёхстворчатого клапана.
На долю данного порока приходится около 1% от всех врожденных пороков сердца. Кроме того, у 75% людей с данной патологией дополнительно отмечается еще и дефект межпредсердной перегородки. Также достаточно часто встречаются и патологические проводящие пути, по которым происходит ненормальное проведение импульсов. Это является причиной развития аритмий. Наиболее часто встречаются желудочковые аритмии. Именно они и застойная сердечная недостаточность являются основными причинами гибели больных данной патологией. Если позволить пороку развиваться естественным путем, то 60% больных погибает к 20 годам.
Виды аномалии Эбштейна
Различают 4 типа аномалии Эбштейна:
- I тип – задняя и септальная створки смещены или отсутствуют, передняя клапанная створка подвижна и большая.
- II тип – передняя, септальная и задняя обычно створки присутствуют, но они смещены к верхушке сердца и относительно малы.
- III тип – передняя створка клапана имеет укороченные и слившиеся хорды, ограничения в движении и часто укорочена. Задняя и септальная створки клапана недоразвиты, смещены.
- IV тип – передняя створка у клапана сильно деформирована, а также смещена по направлению выходного тракта из правого желудочка. Задняя створка обычно недоразвита или отсутствует, а септальная представлена фиброзной тканью.
Аномалия Эбштейна: операция конусной реконструкции — первый опыт анатомической коррекции
Наиболее полное первое освещение особенностей аномалии Эбштейна в отечественной литературе дано Р. П. Зубаревым в книге «Аномалия Эбштейна» [1].
В настоящее время накоплен большой материал по эмбриогенезу данного врожденного порока сердца (ВПС). Механизмы, вызывающие нарушение сепарации створок, не установлены. Однако известны данные о частом возникновении данного порока при мутации гена NKX2.5, 10p13-p14, 1p34.3-p36.11 и у женщин, принимавших на ранних сроках беременности бензодиазепин или препараты, содержащие литий [2]. Известны семейные случаи возникновения данного порока [3]. У нас под наблюдением находятся два таких пациента. В одном случае это однояйцевая двойня, так как матери путем экстракорпорального оплодотворения имплантировали одну яйцеклетку, а в другом случае это была монохориальная двойня. У одного ребенка аномалия Эбштейна сочеталась с дефектом межжелудочковой и межпредсердной перегородки и атрезией легочной артерии, у другого с дефектом межпредсердной перегородки. Вторые дети не имеют врожденных пороков сердца. Генетический материал в данных случаях идентичный, как и характер воздействия факторов внешней среды.
Анатомические особенности при данной патологии подробно описаны Н. А. Белоконь и В. П. Подзолковым (1990) [4]. Следует отметить, что данный врожденный порок имеет выраженную индивидуальную вариабельность. Основная анатомическая особенность порока заключается в смещении трехстворчатого клапана в полость правого желудочка по направлению к верхушке сердца, обычно до места соединения приточной и трабекулярной его частей [5, 6]. Степень дисплазии, деформации створок, их структур варьирует в широких пределах:
- нарушается процесс деламинации (отсепаровывания) ткани створок трикуспидального клапана от эндокарда правого желудочка (рис. 2);
- задняя и септальные створки распластываются по эндокарду правого желудочка, и свободные части створок смещены апикально от клапанного кольца;
- хордальный аппарат задней и септальных створок укорачивается или отсутствует;
- происходит смещение в переднеапикальном направлении уровня кооптации створок трикуспидального клапана;
- передняя створка трикуспидального клапана компенсаторно увеличивается, утолщается, в ней часто появляются фенестрации;
- зона истинного трикуспидального кольца расширяется;
- происходит дилятация атриализированной части правого желудочка с истончением в ней миокарда и замещением последнего фиброзом;
- полость правого предсердия значительно увеличивается.
У 90% находившихся под наблюдением пациентов с аномалией Эбштейна был выявлен дефект межпредсердной перегородки. У одного пациента была атрезия легочной артерии, и у двух пациентов недостаточность митрального клапана. Дополнительные пути проведения электрического импульса с предсердий на желудочки были зарегистрированы у 28,5% пациентов.
Естественное течение пациентов с аномалией Эбштейна неблагоприятно. По данным исследования A. Yetman и соавт. (1997), проанализировавших выживаемость 46 новорожденных пациентов с аномалией Эбштейна и цианозом, 70% больных умерли. По данным кардиохирургического отделения ДГБ № 1 г. Санкт-Петербурга у одной женщины была диагностирована замершая беременность плода, наблюдавшегося с диагнозом «аномалия Эбштейна», а двое детей с аномалией Эбштейна погибли на первом месяце жизни. В Самарском кардиодиспансере наблюдался ребенок с выраженной формой аномалии Эбштейна. Ребенок погиб внезапно на дому в возрасте 7 месяцев.
В связи с появлением возможности анатомической коррекции данного порока сердца собственными тканями в раннем возрасте, выполняя операцию конусной реконструкции, можно утверждать, что в решении данной проблемы появился коренной перелом. Важной проблемой остается возможность выделения пациентов, у которых риск внезапной смерти превышает риск выполнения оперативного лечения в раннем возрасте.
Материалы и методы исследования
Данное исследование проводилось на основании анализа клинического материала с 2014 г. по настоящее время. Учитывались результаты операции аномалии Эбштейна в трех кардиохирургических центрах. Клиническая характеристика пациентов приведена в табл.
Результаты
У пациентов, прооперированных в возрасте до 5 лет, с высокой частотой отмечались различные осложнения, в том числе: реципрокные предсердно-желудочковые (28,5%) и нереципрокные предсердные нарушения ритма (33,3%), наличие сопутствующих пороков сердца и декомпенсация гемодинамики.
Среди них был пациент 11 месяцев. Ребенок поступил в стационар по экстренным показаниям в связи с выраженной тромбоцитопенической пурпурой. Хроническая гипоксемия привела к декомпенсации ДВС-синдрома. Во время операции в полости правого желудочка у этого пациента был выявлен и удален плоский организовавшийся тромб.
Другой пациент был прооперирован по поводу аномалии Эбштейна на вторые сутки жизни. Масса тела ребенка составляла 2 кг 300 г. Он был вторым из двойни. Первый ребенок здоров. Операция потребовалась по экстренным показаниям в связи с наличием у ребенка атрезии легочной артерии и гемодинамикой, зависящей от функционирования артериального протока. Ребенку в условиях искусственного кровообращения была выполнена анатомическая коррекция аномалии Эбштейна, закрыт дефект межпредсердной перегородки, дефект межжелудочковой перегородки и легочная артерия реконструирована венозным клапансодержащим гомографтом. По данным литературы подобная успешная коррекция выполнена впервые в мире.
У третьего ребенка прогрессировала легочная гипертензия на фоне большого дефекта межжелудочковой перегородки.
Четвертый пациент был 5 лет. Ему операция выполнялась по срочным показаниям в связи с остро развившейся брадиаритмией (частота сердечных сокращений 36–48 ударов в минуту) через 2 месяца после повторной радиочастотной абляции. Радиочастотная абляция выполнялась по поводу дополнительных проводящих путей, приводящих к постоянно рецидивирующей атриовентрикулярной реципрокной гемодинамически значимой тахикардии. У него появилась полная атриовентрикулярная блокада. Во время операции ему был имплантирован постоянный двухкамерный кардиостимулятор, и через 2 месяца по данным холтеровского мониторирования у него 86% времени регистрировался правильный синусовый ритм. Результаты обобщены в рис. 1.
При анализе показания для выполнения оперативного лечения аномалии Эбштейна в раннем возрасте выделены следующие основные звенья нарушения гемодинамики, выявленные у всех оперированных пациентов:
- уменьшение полости правого желудочка за счет смещения уровня кооптации створок к верхушке сердца, приводящее к нарушению диастолической функции правого желудочка;
- регургитация на трикуспидальном клапане вызывала объемную перегрузку правых отделов сердца и приводила к прогрессирующей дилатации атриализированной части правого желудочка и правого предсердия при наблюдении в динамике;
- атриализированная часть правого желудочка выбрасывает кровь в ретроградном направлении, увеличивая объемную перегрузку правых отделов сердца;
- тахиаритмии нарушали механизмы компенсации, вызывая острую сердечно-сосудистую недостаточность.
Данные нарушения гемодинамики взаимосвязаны, прогрессируют со временем и при возникновении нарушений ритма носят жизнеугрожающий характер. В связи с этим риск откладывания оперативного лечения превышает риск выполнения операции у детей раннего возраста.
Существенную роль в патогенезе заболевания имеет прогрессирующее замещение мышечной ткани правого желудочка в атриализированной части фиброзом. По данным операционного материала получены морфологические препараты, представленные на рис. 2, 3 и 4.
На этом препарате зафиксировано выраженное утолщение эндокарда. Выраженные признаки фиброза в эндомизии и склеротические изменения истонченного миокарда.
На всех препаратах выраженное замещение соединительнотканным матриксом миокарда.
Убедительным примером морфологических изменений в атриализированной части правого желудочка может служить операционная фотография, характеризующая нативный вид атриализированной стенки правого желудочка после отсепаровывания задней створки трикуспидального клапана. Так выглядел миокард приточного отдела правого желудочка у всех пациентов (рис. 5).
Стенка атриализированной части правого желудочка после сепарации створок представляет собой слой эпикарда и миокарда толщиной 2–3 мм. Ее функциональные возможности сомнительны. Риск развития аневризмы и риск возникновения в ней круговых электрических токов достаточно велик.
Суммируя анатомические изменения, вызывающие нарушения гемодинамики и морфофункциональные изменения в полости правого желудочка, можно сделать вывод о том, что пациенты с выраженной формой аномалии Эбштейна должны быть прооперированы в раннем детстве, могут быть прооперированы в подростковом возрасте и не все взрослые пациенты с аномалией Эбштейна смогут перенести операцию по радикальной коррекции порока сердца.
У 19 пациентов с аномалией Эбштейна была проведена операция по конусной реконструкции.
У всех пациентов операция выполнялась на остановленном сердце. В среднем время пережатия аорты составило 127 ± 34 минуты. Кардиоплегия выполнялась раствором Кустодиол. Кардиоплегия повторялась через 90–110 минут. Гипотермия во время коррекции составляла 28–32 °С.
Схема операции представлена на рис. 6.
Цель данной операции — создание конуса из тканей трикуспидального клапана без подтягивания створок к фиброзному кольцу. Важно при этом, чтобы сохранялась подвижность и парусность створок, а папилярные мышцы хордального аппарата были максимально сближены между собой. У 7 пациентов отсутствовали краевые хорды задней и септальной створок, а у двух и передних створок трикуспидального клапана. Хорды были созданы, после отсепаровывания створок путем разрезов на 1/4 длины створок, от края их прикрепления к миокарду. Существенным моментом данной операции явилось перемещение задней створки на 180 градусов по часовой стрелке к септальной створке. Ее подвижность при этом обеспечивалась отсечением апикального края створки от миокарда и повторной фиксацией его к участкам септальной створки, смещенным к верхушке сердца или непосредственно к эндокарду правого желудочка. Дискутабельным вопросом остается необходимость иссечения атриализированной части правого желудочка или его пликация. В данном исследовании у 7 пациентов из 19, включая новорожденного ребенка, атриализированная часть миокарда в межсосудистой зоне иссекалась. Именно у этих пациентов удалось достичь наилучшего восстановления формы приточной части правого желудочка. Следует отметить, что у 8 пациентов это было сделать невозможно из-за рассыпного типа коронарных артерий. Пликация атриализированной части правого желудочка обеспечивалась П-образными швами с большими велюровыми прокладками для предупреждения прорезования швов. Этот риск обусловлен истончением и нарушением прочности миокарда в атриализированной части правого желудочка. У всех пациентов выполнялось сужение фиброзного кольца. У двух пациентов сужение фиброзного кольца выполнялось на уровне «3» и «10» часов. У всех пациентов потребовалось ушивание отверстий в створках клапанов для создания конуса. Большое значение имеет создание опоры для задней створки благодаря дополнительным фиксирующим швам между задней и септальной створками, обеспечивающим роль раскрытия «паруса».
У 16 пациентов трикуспидальный клапан был реимплантирован в фиброзное кольцо непрерывным обвивным швом. По данным приведенного материала, непрерывный шов в зоне атриовентрикулярного узла проводился с «выходом» на правое предсердие. У одного пациента в конце был сразу имплантирован двухкамерный электрокардиостимулятор с двумя эпикардиальными электродами, так как он оперировался по срочным показаниям в связи с развившейся полной атриовентрикулярной блокадой через два месяца после выполнения повторной радиочастотной абляции. У этого пациента в течение 4 лет постоянно рецидивировала атриовентрикулярная реципрокная тахикардия.
В раннем послеоперационном периоде 16 пациентов потребовали назначение допамина и 4 пациентов кратковременный курс в течение 1–5 дней назначения адреналина.
У одного пациента потребовалось выполнить на четвертые сутки операцию по созданию двунаправленного кавопульмонального анастомоза.
Время наблюдения пациентов после операции составило от 2 месяцев до 3,5 лет. В среднем 1,8 ± 0,74 года. Всем пациентам выполнялось ультразвуковое исследование каждые 3–6 месяцев. Важным прогностическим признаком является эффективная реконструкция приточного отдела правого желудочка: ушивание или резекция атриализированной части правого желудочка. Сближение папилярных мышц или участков прикрепления хорд между собой.
Через 3 месяца после выписки только 6 пациентов получали ингибиторы ангиотензинпревращающего фермента. У всех пациентов сохранялась высокая толерантность к физической нагрузке. По данным динамического наблюдения за электрокардиограммой в группе оперированных пациентов рецидивов пароксизмальных изменений выявлено не было.
Следует отметить, что анатомия аномалии Эбштейна всегда носит индивидуальный характер. В связи с эти решение о характере лечения принимается всегда индивидуально. Операция конусной реконструкции успешно корригирует анатомические нарушения и тоже всегда носит строго индивидуальный характер. По мере накопления опыта и клинического материала данная операция должна войти в основной арсенал отделений детской и взрослой кардиохирургии.
Выводы
- Конусная реконструкция — операция, позволяющая выполнить анатомическую коррекцию врожденного порока сердца — аномалии Эбштейна в любом возрасте.
- При возникновении жизнеугрожающих осложнений данная операция может быть выполнена в раннем возрасте, включая новорожденных детей.
- По полученным результатам данная операция может быть выполнена и у людей старшего возраста с обязательным учетом сократительной функции правого и левого желудочков.
Литература
- Зубарев Р. П. Аномалия Эбштейна. М.: Медицина, 1975. 112 с.
- Park J. M. Ebsten’s anomaly of the tricuspid valve associated with prenatal exsposure to lihium carbonate // Amer. J. Dis. Child. 1980. Vol. 134. № 7. P. 703–704.
- Attenhofer Jost C. H., Connolly H. M., Dearani J. A., Edwards W. D., Danielson G. K. Ebstein’s anomaly. Circulation. 2007. 115 (2): 277–285. doi:10.1161/ CIRCULATIONAHA.106.619338. PMID 17228014.
- Белоконь Н. А., Подзолков В. П. Врожденные пороки сердца. М.: Медицина, 1990. 352 с.
- Dearani J. A., Bacha E., da Silva J. P. Cone Reconstruction of the Tricuspid Valve for Ebstein’s Anomaly: Anatomic Repair.
- Reddin G., Poterucha J. T., Dearani J. A., Warnes C. A. et al. Cone Reconstruction of Atypical Ebstein Anomaly Assosiated with Right Ventricular Apical Hypoplasia // Tex Heart Inst J. 2021 Feb; 43 (1): 78–80. DOI: 10.14503/THIJ-15–5011.
В. А. Болсуновский*, 1, кандидат медицинских наук Г. Г. Хубулава**, доктор медицинских наук, профессор, академик РАН Г. А. Новик*, доктор медицинских наук, профессор М. В. Жданова*, кандидат медицинских наук Р. Р. Мовсесян***, доктор медицинских наук, профессор, член-корреспондент РАН С. Е. Шорохов****, доктор медицинских наук М. С. Хохлунов**** А. В. Болсуновский*
* ФГБОУ ВО СПбГПМУ МЗ РФ, Санкт-Петербург ** ФГБВОУ ВО ВМА им. С. М. Кирова Минобороны РФ, Санкт-Петербург *** СПб ГБУЗ ДГБ № 1, Санкт-Петербург **** ГБУЗ СОККД, Самара
1 Контактная информация
Причины развития аномалии Эбштейна
Как известно, во внутриутробном периоде, сердце человека формируется в первые 9 недель беременности. Именно в это время и закладываются все врожденные пороки развития сердца.
Именно в этот период обуславливается и аномалия Эбштейна. Происходит это под воздействием целого ряда факторов:
- вирусных инфекций;
- скарлатины;
- кори;
- краснухи;
- употребления некоторых лекарственных средств (седативных, снотворных, препаратов лития);
- наркотиков;
- алкоголя.
Важную роль играет и отягощенная наследственность. Следует отметить, что вышеуказанные причины обуславливают не только аномалию Эбштейна, но и практически все другие врожденные пороки сердца.
Причины и факторы риска
Предполагается, что к возникновению аномалии Эбштейна ведут мутации в локусе хромосомы 17q CFA9, дупликация хромосомы 15q, дефект рецептора ALK3/BMPR. Хромосомные нарушения возникают на этапе слияния родительского генетического материала или на ранних сроках беременности и приводят к некорректному формированию органов и тканей организма ребенка во внутриутробном периоде.
Поскольку точные причины заболевания пока не установлены, наиболее вероятными факторами риска считаются:
- прием матерью препаратов лития во время беременности;
- прием матерью бензодиазепинов во время беременности;
- перенесенные на ранних сроках беременности вирусные заболевания (грипп, краснуха, корь);
- многократное спонтанное прерывание беременности на ранних сроках в анамнезе;
- хроническая интоксикация пестицидами, парами лакокрасочных веществ, продуктами переработки нефти и т. п. (проживание в экологически неблагополучных районах, работа на вредных производствах);
- употребление родителями запрещенных веществ, злоупотребление алкоголем, курением.
Вирусные заболевания на ранних сроках беременности могут привести к развитию аномалии Эбштейна у плода
Патофизиология аномалии Эбштейна
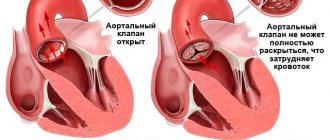
Вследствие того, что створки клапана образованы из тканей желудочка и локализуются в нем же, то происходит значительное уменьшение его полости. Соответственно уменьшению полости предсердия уменьшается и объем крови, выбрасываемый сердцем в легочной ствол.
Также не следует забывать о том, что створки клапана имеют ненормальную форму и не способны полностью изолировать полость желудочка от полости предсердия. Происходит заброс крови в предсердие, что вызывает застой крови в последнем и его гипертрофию. А поскольку сопровождает это все часто еще и дефект перегородки, то кровь сбрасывается в левое предсердие, что ведет к смешиванию артериальной и венозной крови и снижению насыщения крови кислородом.
Лечение
Основным способом радикального устранения аномалии Эбштейна является хирургическое вмешательство, которое может осуществляться в один или несколько этапов.
У 90% пациентов с аномалией Эбштейна после хирургического лечения отмечаются положительные непосредственные и отдаленные результаты.
Показания к хирургическому лечению:
- сердечная недостаточность III–IV ФК (функциональных классов);
- значительный или прогрессирующий цианоз – уровень насыщения крови кислородом (индекс сатурации) менее 80%;
- тяжелая кардиомегалия с кардиоторакальным индексом больше 0,65;
- сопутствующие аномалии сердца;
- предсердные и желудочковые аритмии;
- наличие парадоксальной эмболии в анамнезе.
Реконструктивные операции включают исправление трикуспидального клапана, его перемещение, замещение (протезирование), закрытие предсердной перегородки, пластику атриализированной части правого желудочка.
Хирургическое вмешательства – основной метод лечение аномалии Эбштейна
Хирургическое лечение улучает выживаемость, прогноз, предупреждает развитие или существенно уменьшает выраженность аритмий.
Симптомы аномалии Эбштейна
Клинические симптомы аномалии Эбштейна напрямую зависят от степени недостаточности трехстворчатого клапана, вида нарушения сердечного ритма, количества сбрасываемой крови через дефект межпредсердной перегородки, а также от степени сужения выходного отдела ПЖ (правого желудочка).
У новорожденных с III и IV типами аномалии Эбштейна развивается тяжелая гипоксемия после закрытия Боталлова протока (открытый артериальный проток).
- Больные начинают предъявлять жалобы на возникновение одышки, повышение утомляемости, боли в области сердца, сердцебиение (ощущение сокращений сердца).
- Кожные покровы синюшные (цианотичные).
- Появляются отеки на нижних конечностях (следствие венозного застоя).
- У больных изменяются концевые фаланги рук и ног (вид «часовых стекол» и «барабанных палочек»).
Все эти симптомы свидетельствуют о том, что ткани организма испытывают недостаток кислорода.
Диагностика
При объективном обследовании сердечно-сосудистой системы определяются:
- расширение границ сердечной тупости вправо и влево;
- глухие, ослабленные тоны сердца, часто выслушивается ритм галопа, то есть трех- или четырехчленный ритм, обусловленный раздвоением I и II тонов сердца или наличием дополнительных III и IV тонов.
Аномалия Эбштейна встречается крайне редко: на его долю приходится не более 1 случая из 100 (по некоторым данным – 200) врожденных пороков сердца.
Данные инструментальных методов исследования следующие:
- при ЭКГ низкого вольтажа – выраженные остроконечные зубцы Р, которые указывают на гипертрофию и дилатацию правого предсердия, блокада правой ножки пучка Гиса, признаки синдрома Вольфа – Паркинсона – Уайта (WPW);
- при рентгенографии – кардиомегалия, снижение интенсивности легочного рисунка, в боковой проекции – аномальное наполнение ретростернального пространства;
- при УЗ-исследовании сердца – удлинение, утолщение и провисание лепестков трехстворчатого клапана, расширение правого предсердия, при допплерографии – характерный «воющий» звук движения створок;
- при катетеризации сердца (производится в редких случаях) – повышенное давление в правом предсердии;
- при ангиокардиографии – гигантская, резко расширенная полость правого предсердия с высокой интенсивностью контрастирования.
Рентгеновский снимок аномалии Эбштейна
Диагностика аномалии Эбштейна в Израиле
- При аускультации сердца – глухие первый и второй тоны.
- Рентгенография: увеличение размеров правого предсердия, обеднение легочного кровотока, кардиоторакальный индекс часто приближается к единице.
- ЭКГ (электрокардиография): отмечаются признаки гипертрофии правого предсердия.
- ЭхоКГ (эхокардиография).
- Фетальная эхокардиография(ЭхоКГ): пренатально (во время беременности) порок диагностируется в 60% случаев. Основным симптомом является выраженное увеличение сердца в размерах в основном за счет правого предсердия. На трикуспидальном клапане, регистрируется регургитация (обратный ток крови) различной степени.
- Катетеризация сердца и правая контрастная атриография.
Прогноз
Ранний дебют заболевания в детском или юношеском возрасте – прогностически неблагоприятный признак.
При диагностике грубых нарушений вероятность выживания новорожденного – 75% в течение первого месяца жизни. До полугода доживают 68%, до 5 лет – 64%, в последующем кривая летальности стабилизируется.
Вероятность смертельного исхода при оперативном вмешательстве зависит от тяжести аномалии в каждом конкретном случае, наличия сопутствующей патологии. У 90% пациентов после хирургического лечения отмечаются положительные непосредственные и отдаленные результаты. В течение года возможно восстановление трудоспособности.
Признаки и симптомы
Рассмотрим симптомы инфекционного мононуклеоза, который является проявлением первичного контакта ребенка с вирусом Эпштейна-Барр. Иногда мононуклеоз у детей вызывает цитомегаловирус (ЦМВ; дифференциальный серологический анализ всегда необходим).Заболевание начинается остро и длится от 3 до 4 недель.
При мононуклеозе (если его причина ВЭБ, а не цитомегаловирус) проявляется следующая симптоматика. Её обнаруживают при непосредственном осмотре ребенка:
1. Повышение температуры тела до 39-40 градусов с тяжелым интоксикационным синдромом –тошнота, рвота, слабость, головная боль, тахикардия;
2. Увеличение лимфатических узлов по всему телу (особенно на шее – передне- и заднешейные узлы);
3. Назофарингит и тонзиллит с бело-серыми или желтоватыми налетами (из-за поражения небных миндалин и аденоидов);
4. Утрудненное носовое дыхание при отсутствии выделений из носовых ходов, одутловатость лица,гнусавость голоса;
5. Увеличение печени и селезенки (гепатоспленомегалия у детей), боли в брюшной полости,иктеричность склер и кожи;
6. Экзантема(высыпания вирусного происхождения) в виде пятен, папул, везикул с повсеместной локализацией.
Анализы:
При микроскопическом исследовании в период острой инфекции среди обычных кровяных клеток находят большие атипичные лимфоциты, что поражены вирусом, –мононуклеары (такую картину крови иногда дает цитомегаловирус, ЦМВ). Они сохраняются в кровяном русле на протяжении месяца с момента заражения.
Для серологической диагностики мононуклеоза используют иммуноферментный анализ(ИФА) или полимеразноцепную реакцию (ПЦР), с помощью какой выявляют вирус Эпштейна-Барра.
Какие антитела (АТ) типов IgG и IgM (иммуноглобулин М, G) являются диагностическими, когда проводят ИФ-анализ?
| Вид антител | Характеристика |
| Анти-VCA антитела класса IgM (иммуноглобулин М к капсидному антигену) | Вырабатываются при острой ВЭБ-инфекции, циркулируют в крови 2-3 месяца. Повторно синтезируются в случае реактивации вируса. Высокая концентрация анти-VCA IgM, что длительно сохраняется, – свидетельство хронической формы ВЭБ. |
| Анти-EA антитела класса IgG (иммуноглобулин G к раннему антигену) | Появляются в крови на 3-4 неделе от начала острой ВЭБ-инфекции, сохраняются в течение 2-6 месяцев. Вновь анти-EA IgG появляются при реактивации возбудителя. |
| Анти-EBNA антитела класса IgG (иммуноглобулин G к ядерному антигену) | Начинают циркулировать в кровяном русле через 1-6 месяцев после первичного ВЭБ-заболевания. Постепенно их концентрация уменьшается. Анти-EBNA IgG может быть обнаружен до конца жизни человека (их всегда выявляет ИФ-анализ). |
Если был проведен ИФ-анализ, положительный результат, выявивший
:
· антителатипа IgG (иммуноглобулин G) против ядерного и ранних антигенов;
· антителатипа IgM (иммуноглобулин М) к капсидному (VCA) антигену вируса