Фармакологические свойства препарата Фозиноприл
Ингибитор АПФ. Уменьшает образование ангиотензина II из ангиотензина I, что приводит к снижению ОПСС и системного АД. Подавляет синтез альдостерона в надпочечниках. Начало терапевтического действия отмечается через 1 ч после приема внутрь, максимальное снижение АД достигается в течение 3–6 ч. Гипотензивное действие сохраняется в течение 24 ч, однако для достижения стойкого гипотензивного эффекта у некоторых больных может потребоваться 2–3 нед. В ходе длительного лечения эффект сохраняется. После приема внутрь в пищеварительном тракте абсорбируется около 36% фозиноприла; степень абсорбции не зависит от приема пищи. Гидролиз фозиноприла с образованием фармакологически активного фозиноприлата происходит в слизистой оболочке пищеварительного тракта и частично в печени. Максимальная концентрация фозиноприлата в плазме крови достигается через 3 ч. Связывание с белками плазмы крови — 95%. Не проникает через ГЭБ. Фозиноприлат выводится в неизмененном виде с мочой и желчью. Период полувыведения — 11,5 ч. У пациентов с почечной недостаточностью не наблюдается заметного изменения фармакокинетики фозиноприла за счет компенсаторного увеличения выделения его печенью. У пациентов с нарушением функции печени возможно незначительное уменьшение гидролиза фозиноприла. Имеются данные о компенсаторном увеличении выделения фозиноприла почками при одновременном снижении печеночного клиренса фозиноприла у этой категории пациентов.
Введение
В новом тысячелетии проблемы артериальной гипертензии (АГ) и хронической сердечной недостаточности (ХСН) приобрели неожиданную остроту. Эти грозные заболевания связаны общностью причинно–следственных взаимоотношений. Доказано, что АГ является одной из важнейших причин развития ХСН. По данным Фремингемского исследования, среди факторов риска ХСН, таких как гипертрофия левого желудочка (ЛЖ), перенесенный инфаркт миокарда (ИМ), стенокардия напряжения, сахарный диабет (СД), клапанные пороки сердца, повышенное артериальное давление (АД) является наиболее точным предиктором развития этого патологического состояния [1]. В западных странах роль АГ как причины развития ХСН становится ведущей в старших возрастных группах, приводя к нарушению диастолической, а в дальнейшем – и систолической функции миокарда. В нашей стране АГ занимает 80 % в структуре причин ХСН и способствует ее декомпенсации в основном за счет диастолической дисфункции [2]. Так, по данным Российского эпидемиологического исследования ЭПОХА–О–ХСН, доля амбулаторных больных с ХСН и сохраненной фракцией выброса (ФВ) ЛЖ (> 40 %) превышает 80 % [3]. Это связывают не с увеличением числа пожилых лиц, как в Европе, а с широким распространением и неэффективным лечением АГ. В Европейском исследовании EuroHeart Survey HF аналогичный показатель составляет 53 % [4].
В настоящее время не вызывает сомнений прямая взаимосвязь патогенетических механизмов развития и прогрессирования АГ и ХСН. Декомпенсация сердечной деятельности является одним из наиболее опасных осложнений АГ. При АГ гемодинамическая перегрузка приводит к ремоделированию как сердца, так и периферических сосудов. В итоге формируется гипертоническое сердце, что проявляется развитием диастолической, а затем и систолической дисфункции ЛЖ со снижением сердечного выброса. Ремоделирование периферических сосудов сопровождается повышением пред– и постнагрузки, включением почечных механизмов развития ХСН. С современных позиций сердечно–сосудистого континуума ремоделирование сердечно–сосудистой системы рассматривается, во–первых, как осложнение АГ и предвестник клинических проявлений ХСН, а во–вторых, как фактор прогрессирования АГ и предиктор декомпенсации сердечной деятельности [5]. Принимая во внимание, что АГ – один из основных факторов риска сердечно–сосудистого континуума, а ХСН – один из его заключительных этапов, успешное лечение с воздействием на их общую патогенетическую основу, т. е. на ремоделирование, можно рассматривать как профилактику развития сердечной декомпенсации. Помимо гемодинамических механизмов важную роль в прогрессировании как АГ, так и ХСН играет хроническая гиперактивация нейрогормональных систем, которая является не только связующим звеном в патогенезе обоих заболеваний, но и главной составляющей процессов ремоделирования [6]. Поэтому в лечении обеих патологий наиболее оправданно использование нейрогормональных модуляторов, в первую очередь ингибиторов ангиотензинпревращающего фермента (ИАПФ).
Настоящий бум в области изучения различных аспектов АГ и ХСН, а также проведение многоцентровых плацебо–контролируемых клинических испытаний лекарственных средств привели к кардинальному пересмотру национальных и международных рекомендаций по диагностике и лечению АГ и ХСН. Но, несмотря на многочисленные публикации и монографии, изданные в последние годы и посвященные этим проблемам, практикующие врачи по–прежнему испытывают определенные трудности при выборе лекарственных средств, особенно при сочетании нескольких сердечно–сосудистых заболеваний, например АГ и ХСН.
Роль ИАПФ в терапии АГ и ХСН
ИАПФ и в XXI в. остаются одними из наиболее эффективных средств лечения кардиологических больных. Убедительно доказана польза их применения в профилактике сердечно–сосудистых заболеваний, включая ХСН, у больных как с наличием, так и с отсутствием АГ. Лечение ИАПФ у больных АГ ассоциируется со снижением риска развития ХСН в среднем на 16 % [7]. Этот класс препаратов занимает лидирующее положение среди средств лечения ХСН, оказывая модулирующее действие на общие патофизиологические механизмы АГ и ХСН за счет снижения активности ренин–ангиотензин–альдостероновой системы (РААС) путем блокады образования активного ангиотензина–II (А–II), а также активации системы брадикинина. Оценивая роль ИАПФ в терапии ХСН, Braunwald E. (1991) называл их “краеугольным камнем в лечении ХСН”, альфа Cohn J. (1998) – “золотым стандартом терапии”. Четверть века, прошедшую со времени создания первого ИАПФ – каптоприла, ныне называют “эрой ИАПФ”. Фармакологические эффекты ИАПФ при АГ и ХСН качественно одинаковы. В то же время артериальная вазодилатация со снижением постнагрузки и АД играет важную роль при АГ, а венозная вазодилатация со снижением преднагрузки – при ХСН. Замедление процессов ремоделирования сердца имеет особое значение при обоих заболеваниях. Для АГ в первую очередь необходимо улучшение диастолической функции, для ХСН – как диастолической, так и систолической функции ЛЖ. Нефропротективные свойства ИАПФ имеют значение при обоих патологических состояниях, а антиаритмический эффект этого класса препаратов – при ХСН.
Эффективность ИАПФ доказана при любой степени тяжести (функциональном классе – ФК) ХСН: исследования SOLVD–prevention (I ФК), SOLVD–treatment (II ФК), V–HeFT II (III ФК), CONSENSUS (IV ФК). Показано, что ИАПФ снижают риск смерти у больных с ХСН на 23 %. Они являются препаратами первого ряда для лечения ХСН с систолической дисфункцией ЛЖ, т. к. это единственная группа лекарственных средств, способных не только уменьшать проявления ХСН, но и значительно замедлять прогрессирование ремоделирования, улучшать отдаленный прогноз [6]. Подтверждено главенствующее положение ИАПФ в предотвращении и замедлении ремоделирования ЛЖ и у больных с диастолической дисфункцией (исследование PREAMI) [8]. Они положительно влияют на такие параметры ремоделирования, как индексы сферичности и относительной толщины стенок, миокардиальный стресс [9], способствуют поддержанию нормальных ФВ и массы миокарда ЛЖ [10] за счет торможения активации РААС, стабилизации уровня брадикинина и высвобождения оксида азота [11]. Показан и более значительный регресс гипертрофии ЛЖ при лечении ИАПФ по сравнению с другими препаратами [12], обусловленный не только снижением системного АД, но также их антипролиферативным действием на кардиомиоциты и фибробласты миокарда. Поскольку частота ритма, сердечный выброс и давление заклинивания легочных капилляров на фоне применения ИАПФ изменяются незначительно, предполагают их вероятное воздействие непосредственно на расслабление миокарда. Эффект улучшения диастолической функции под влиянием ИАПФ связывают с уменьшением гипертрофии и увеличением “податливости” стенок ЛЖ, снижением постнагрузки и подавлением аномального коллагенообразования в интерстиции путем нейрогуморального воздействия (снижение активности
А–II, альдостерона, блокирование деградации брадикинина, улучшение функции эндотелия). Однако ряд вопросов, касающихся механизмов их положительного влияния при АГ и ХСН, остается открытым.
В серии исследований (AIRE, SAVE, SOLVD, TRACE, V–HeFT и др.) показано антиишемическое действие ИАПФ. Механизмы его еще уточняются, но определенную роль отводят замедлению ремоделирования коронарных артерий, улучшению перфузии субэндокарда при уменьшении конечного диастолического давления ЛЖ или изменении нейрогормональных влияний, стабилизации атеросклеротических бляшек и улучшению эндотелиальной функции вследствие прямого тканевого эффекта ИАПФ [13, 14]. В эксперименте показана возможность новообразования капиллярной сети в миокарде за счет влияния ИАПФ на метаболизм брадикинина.
Считают, что у больных ХСН с сохраненной систолической функцией, как правило, не происходит заметного повышения системного уровня ренина и А–II, но отмечается активация локальной РААС, поэтому у них перспективны ИАПФ с высоким сродством к тканевому АПФ [13]. Однако доказательств эффективности ИАПФ при диастолической ХСН в настоящее время мало. Всего в нескольких исследованиях (HOPE, EUROPA) подтвержден их эффект у больных ИБС без дисфункции ЛЖ [7, 14], а влияние на диастолическое наполнение ЛЖ у больных ХСН изучалось лишь в небольших клинических работах. При этом авторы чаще отмечали благоприятное действие ИАПФ в виде перераспределения кровотока с увеличением в раннюю и уменьшением в позднюю фазы диастолы, что свидетельствует об улучшении активной релаксации миокарда ЛЖ [15, 16].
В то же время имеются указания на противоположные изменения трансмитрального диастолического потока [10] и даже на отсутствие положительной динамики диастолических индексов при длительной терапии эналаприлом, каптоприлом, лизиноприлом, периндоприлом и другими ИАПФ [17, 18]. Вероятным объяснением подобных расхождений может быть разнонаправленный характер изменений трансмитрального диастолического потока в силу наличия исходно не только “гипертрофического”, но и псевдонормального или рестриктивного типов диастолической дисфункции. Полагают также, что эффективность влияния ИАПФ на гипертрофию миокарда и диастолическую релаксацию зависит от наличия у пациентов гена полиморфизма АПФ [19].
Проблема оптимального выбора ИАПФ
В связи с наличием на рынке различных ИАПФ (в России зарегистрировано 12 оригинальных молекул разных препаратов этого класса) возникает вопрос об их оптимальном выборе. При этом для обоснования пользы того или иного ИАПФ необходима вдумчивая и всесторонняя оценка врачом диапазона не только фармакологических свойств, но и имеющихся доказательств его клинической эффективности и безопасности. “Идеальный” ИАПФ должен сочетать высокую, доказанную в клинических исследованиях эффективность и максимальную безопасность, иметь минимум побочных эффектов. Известно, что большое влияние на выбор ИАПФ оказывают привычка и вера врача, социально–экономические факторы (включая стоимость лечения), тяжесть состояния больного, индивидуальная переносимость и т. п.
Хотя принципиальных различий между отдельными ИАПФ не обнаружено, достоверное влияние на симптоматику заболевания, качество жизни, прогноз и безопасность при ХСН доказано в международных исследованиях только для шести препаратов (каптоприл, эналаприл, фозиноприл, лизиноприл, рамиприл, периндоприл) и еще для двух (спираприл, квинаприл) – в многоцентровых российских программах ВНОК и ОССН. В данном обзоре анализируются имеющиеся данные по оценке фармакологических и клинических особенностей фозиноприла, благодаря которым он имеет ряд преимуществ перед другими ИАПФ в лечении и профилактике ХСН у больных с наличием АГ. Не так давно на отечественном фармацевтическом рынке появился препарат Фозикард® (компания Актавис), который стал первым качественным генерическим аналогом фозиноприла. Высокое качество, эффективность и безопасность Фозикарда® подтверждены результатами исследования по оценке его биоэквивалентности оригинальному фозиноприлу. Несмотря на то что данный препарат – типичный представитель класса ИАПФ, он имеет определенную структурную особенность – содержит в химической формуле фосфонильную группу. Эта особенность придает ему ряд уникальных свойств, выгодно отличающих его от других препаратов этого класса и позволяющих отнести к третьей (наиболее современной) генерации ИАПФ [20].
Клинико–фармакологические свойства фозиноприла
Фозиноприл является пролекарством, т. е. действует после всасывания и трансформации в активный метаболит – фозиноприлат, который циркулирует в связанном с белками плазмы крови (95–98 %) состоянии с периодом полувыведения (у здоровых лиц) около 12 часов. К достоинствам фозиноприла относят высокое сродство к липидам – индекс липофильности фозиноприлата составляет более 2,0 ЕД, тогда как у периндоприлата он равен 0,872; а у эналаприлата – 0,108 ЕД [21]. Это облегчает проникновение фозиноприлата через клеточные мембраны и позволяет подавлять активность не только циркулирующей, но и тканевой РААС в сердце, легких, почках и головном мозге. Экспериментально показано, что фозиноприлат ингибирует АПФ в сердечной мышце в большей степени, чем рамиприлат и эналаприлат [22], что лежит в основе более выраженного (по сравнению с другими ИАПФ) гипотензивного и кардиопротективного эффектов.
Еще одним важным свойством фозиноприла, нашедшим реальное применение в клинике, является двойной взаимокомпенсирующий путь элиминации. В отличие от каптоприла, эналаприла, лизиноприла и периндоприла, которые выводятся из организма преимущественно почками, для фозиноприла характерны два основных пути элиминации – почечный и печеночный (с желчью) в соотношении 1 : 1. Причем при снижении функции почек увеличивается выведение активного метаболита с желчью и, наоборот, при печеночной недостаточности возрастает его экскреция с мочой. По данным специальных фармакокинетических исследований, у пациентов с циррозом печени экскреция фозиноприлата с мочой возрастает в 1,5–2 раза по сравнению со здоровыми лицами, а у больных с почечной недостаточностью в 2–3 раза усиливается печеночный путь выведения. Описанная особенность предопределяет безопасное использование фозиноприла у больных и с печеночной недостаточностью (при алкогольном и особенно билиарном циррозе печени), и с нарушенной функцией почек. Даже при снижении скорости клубочковой фильтрации ниже 15 мл/мин концентрация фозиноприла достоверно не увеличивается, что позволяет рассматривать этот препарат как средство выбора при клинических состояниях, чреватых ухудшением функции почек (тяжелой АГ, сопутствующем СД, метаболическом синдроме), и у пожилых лиц, имеющих в большинстве случаев сопутствующую патологию, включая диабетическую нефропатию. Это свидетельствует о важном практическом преимуществе фозиноприла перед другими ИАПФ – отсутствии необходимости контроля функции почек при назначении и увеличении дозировок, что делает его оптимальным препаратом для амбулаторного лечения. Кроме того, не требуется адаптации и снижения дозы фозиноприла у пожилых пациентов, поскольку у больных 65–74 лет с клинически нормальной функцией печени и почек не отмечено изменений в фармакокинетике фозиноприлата по сравнению с молодыми пациентами (20–35 лет).
Наибольшее значение имеет высокая безопасность фозиноприла.
Как известно, основными побочными эффектами, ограничивающими назначение ИАПФ и снижающими приверженность лечению, наряду с ухудшением функции почек являются кашель и гипотония первой дозы, особенно у больных, перенесших острый ИМ и имеющих симптомы ХСН. Кашель у лиц, получающих ИАПФ, обусловлен блокадой разрушения брадикинина и некоторых других нейромедиаторов в слизистой оболочке бронхов. Его появление, непосредственно связанное с приемом ИАПФ, обычно служит показанием к замене ИАПФ препаратом из группы блокаторов рецепторов к А–II. Реальной альтернативой в данном случае также может служить фозиноприл. Имеются доказательства того, что сухой кашель, вызываемый другими ИАПФ, ослабевает или даже полностью исчезает при переходе на фозиноприл. Например, в двойном слепом сравнительном исследовании с эналаприлом показано достоверно более редкое возникновение кашля при назначении фозиноприла. В это исследование были включены 179 больных, уже прекративших прием ИАПФ из–за развития кашля. Попытка возобновления лечения была гораздо более успешной при выборе фозиноприла – повторное развитие кашля наблюдалось более чем вдвое реже по сравнению с эналаприлом [20]. При применении фозиноприла реже встречаются и другие нежелательные явления.
Еще в одном двойном слепом исследовании проводилось прямое сравнение одинаковых дозировок фозиноприла и эналаприла (5–20 мг однократно в сутки) при лечении больных ХСН. При этом число пациентов с гипотонией первой дозы, получавших фозиноприл, было в четыре раза меньше, чем при терапии эналаприлом. Кроме того, при применении фозиноприла в этом исследовании выявлено достоверно большее снижение риска комбинированной конечной точки (смерть + утяжеление декомпенсации).
Фозиноприл отличает и удобный режим дозирования – однократный прием обеспечивает 24–часовой контроль АД (соотношение остаточного к пиковому эффекту – 64 %) и предотвращает его повышение в ранние утренние часы. Начальная суточная доза фозиноприла при АГ составляет 10 мг однократно с возможным последующим увеличением до 20–40 мг. При ХСН начальная суточная доза – 5–10 мг (у больных с гипотонией – 2,5–5 мг), средняя терапевтическая – 10–20 мг, максимальная – 20–40 мг.
Клинические исследования эффективности фозиноприла
Высокая эффективность фозиноприла при АГ подтверждена в международных и российских исследованиях. По данным исследования FOPS, он эффективно снижает АД у 80 % больных, причем у пациентов с мягкой и умеренной АГ это не сопровождается компенсаторной тахикардией. Проведенный мета–анализ показал, что антигипертензивная активность фозиноприла прогрессивно увеличивается на протяжении первых нескольких недель лечения вплоть до достижения целевых уровней АД без проявления элементов компенсаторных нарушений сердечного ритма, а отмена препарата не вызывает быстрого подъема АД. Эффективность фозиноприла, как правило, не зависит от возраста, пола и массы тела [23, 24].
По гипотензивной активности фозиноприл достоверно не уступает диуретикам, бета–адреноблокаторам, антагонистам кальция и другим ИАПФ, но отличается лучшей переносимостью и меньшим числом клинических и биохимических побочных эффектов, особенно в “группах риска” – у пожилых лиц или больных СД, что было продемонстрировано в исследовании FACET, в котором эффективность и безопасность фозиноприла и антагониста кальция амлодипина сопоставлялись у больных с инсулиннезависимым СД и АГ [25]. За три года терапии при удовлетворительном и примерно равном контроле АД в группе фозиноприла было достоверно меньше летальных исходов, ИМ и инсультов, чем на фоне терапии амлодипином (14 против 27 %; p = 0,027). В исследовании FLIGHT по изучению эффективности фозиноприла у 19 432 больных АГ (989 из них старше 75 лет) целевое АД через 12 недель от начала лечения достигнуто у 79,8 % пациентов [26].
В рамках российской программы ФЛАГ (Фозиноприл при Лечении Артериальной Гипертонии) оценивалась вероятность достижения целевых уровней АД у больных с мягкой и умеренной АГ в амбулаторных условиях при монотерапии фозиноприлом (10–20 мг/сут) или его сочетании с гидрохлоротиазидом. Всего в исследование были включены 2557 пациентов, из которых 26,7 % составили лица старше 60 лет. Целевое АД достигнуто у 62,1 % пациентов. Побочные эффекты отмечены у 8,3 % больных, причем только у 5,2 % потребовалась отмена препаратов [27].
В исследование ФАГОТ (Фармакоэкономическая оценка использования ИАПФ фозиноприла в амбулаторном лечении больных Артериальной Гипертонией Осложненного Течения) были включены 2596 пациентов с мягкой или умеренной АГ и наличием двух факторов риска сердечно–сосудистых осложнений. Сравнивалась эффективность монотерапии фозиноприлом или его сочетания с гидрохлоротиазидом и общепринятой терапии (диуретиками, бета–адреноблокаторами, антагонистами кальция) у пациентов разного возраста. Целевое АД при приеме фозиноприла и гидрохлоротиазида достигнуто у 67,8 % пациентов. Показано, что скорость достижения гипотензивного эффекта и его выраженность при применении фозиноприла не различаются у пациентов пожилого и молодого возраста, но выше, чем при использовании традиционной схемы лечения. По сравнению с другими препаратами фозиноприл выгодно отличала простота приема и затратная экономичность [28].
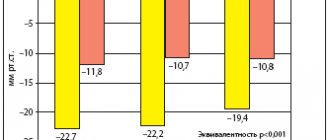
Во многих исследованиях эффективность фозиноприла доказана и при ХСН. Показано, что фозиноприл не только повышает толерантность к нагрузкам и снижает ФК декомпенсации (исследование FEST), но и существенно замедляет прогрессирование ХСН. Терапия фозиноприлом ассоциируется с большей эффективностью, безопасностью и наилучшим соотношением стоимость–эффективность, чем применение других ИАПФ, в частности эналаприла. В исследовании ФАСОН (Фармакоэкономическая оценка использования ИАПФ в Амбулаторном лечении больных с Сердечной Недостаточноcтью), которое включало 1945 больных ХСН II–III ФК, в группе пациентов с сочетанием АГ и ХСН снижение систолического АД составило 12,5 %, диастолического – 11 %, а целевое АД достигнуто у 72 % пациентов [29]. При этом затраты на лечение снижались на 54 %.
К факторам, обеспечивающим преимущество фозиноприла перед другими ИАПФ у больных ХСН, относят и его уникальную способность снижать уровень эндотелина – вазоконстрикторного нейропептида, являющегося предиктором неблагоприятного прогноза больных с декомпенсацией [20]. Возможно, что этот механизм наряду с известными “классическими” путями воздействия ИАПФ (блокадой синтеза А–II, замедлением разрушения брадикинина) обеспечивает фозиноприлу высокую эффективность при применении у больных острым ИМ. В рандомизированном плацебо–контролируемом исследовании FAMIS показано, что раннее (менее 24 часов) присоединение фозиноприла к тромболитической терапии у пациентов с передним острым ИМ приводит к достоверному снижению частоты смертельных исходов и случаев развития тяжелой ХСН (III–IV ФК) на 36,2 % [30].
В результате проведенных клинических исследований получены доказательства возможности использования фозиноприла не только в лечении АГ и ХСН, связанных общностью патогенетических механизмов развития, но и в профилактике прогрессирования сердечной декомпенсации у больных с высоким риском сердечно–сосудистых осложнений. Высокая липофильность фозиноприла, позволяющая ему хорошо проникать в ткани, способность влиять на уровень вазоконстрикторных субстанций (эндотелина) обеспечивают максимальную органопротекторную активность фозиноприла. Как следствие этого – проявляются дополнительные эффекты, отличающие этот препарат от других ИАПФ. Например, в исследовании PHYLLIS доказана способность фозиноприла достоверно замедлять развитие атеросклероза сонных артерий и предотвращать увеличение соотношения интима–медиа стенки сонных артерий у больных АГ с бессимптомным атеросклеротическим поражением каротидного бассейна [31]. Это открывает перспективы к применению данного ИАПФ в лечении больных с атеросклерозом и для снижения риска мозгового инсульта у лиц с АГ и поражением сонных артерий.
Особый интерес представляет исследование PREVEND–IT, в котором доказано, что благодаря нефропротективным свойствам фозиноприл может использоваться в качестве средства первичной профилактики у больных АГ с микроальбуминурией. Кроме того, он предотвращает риск сердечно–сосудистых осложнений: его применение в течение 4 лет у пациентов с микроальбуминурией > 50 мг/24 часа приводило к достоверному снижению риска мозгового инсульта и комбинированной точки, включавшей сумму смертей и госпитализаций в связи с ухудшением состояния [32].
Заключение
Таким образом, с помощью фозиноприла, одного из наиболее эффективных и безопасных представителей класса ИАПФ, можно не только успешно лечить самых тяжелых пациентов с АГ и ХСН (пожилых, с СД, нарушенной функцией почек), но и предупреждать развитие сердечно–сосудистых осложнений, в т. ч. ХСН, у лиц с множественными факторами риска. Поэтому с целью эффективного замедления неуклонного движения больных по сердечно–сосудистому континууму необходимо как можно более раннее назначение этого препарата больным АГ для лечения и профилактики прогрессирования ХСН. Крайне интересной представляется возможность применения фозиноприла с целью воздействия на диастолические расстройства и ремоделирование как процессы, лежащие в основе развития и прогрессирования ХСН у больных АГ. Несмотря на имеющуюся доказательную базу и уникальные фармакокинетические особенности, данный препарат пока мало изучен в этом плане, что может определить перспективы дальнейших исследований его эффектов у больных с сочетанием АГ и ХСН.
Побочные эффекты препарата Фозиноприл
со стороны системы пищеварения: редко — тошнота, рвота, диспепсические явления, повышение активности печеночных трансаминаз; описаны случаи развития панкреатита, гепатита; со стороны дыхательной системы: кашель, редко — фарингит, ларингит, синусит, бронхоспазм; со стороны сердечно-сосудистой системы: сердцебиение, боль в области груди, редко — ортостатическая гипотензия, коллапс, приливы жара, аритмия; аллергические и иммунологические реакции — кожная сыпь, зуд, фотосенсибилизация, ангионевротический отек, миалгия, артралгия; со стороны мочевой системы — протеинурия, олигурия, нарушения экскреторной функции, сопровождающиеся повышением концентрации креатинина и мочевины в плазме крови; прочие реакции — головокружение, усталость, нарушение вкусовой и других видов чувствительности.
Фозиноприл – ингибитор АПФ с особыми свойствами
Классическая схема функционирования РААС была описана еще в середине ХХ в. (рис. 1). Ренин, образующийся в юкстагломерулярном аппарате почек, активирует образование из ангиотензиногена (пептида, вырабатывающегося в печени) неактивного ангиотензина 1 (АТ Ι), который под действием ангиотензинпревращающего фермента (АПФ) (киназы ΙΙ) переходит в активный ангиотензин ΙΙ (АТ ΙΙ). АТ ΙΙ связывается с двумя подтипами рецепторов: преимущественно с АТ1 и в значительно меньшей степени с АТ2. Активация рецепторов АТ1 приводит к вазоконстрикции, пролиферации, активации провоспалительной системы, нарушению функции эндотелия, повышению секреции альдостерона. Активация рецепторов АТ2 вызывает противоположные эффекты, но у взрослых их экспрессия значительно меньше, чем экспрессия АТ1 [4]. Позднее, в конце ХХ в., открыли, что все компоненты РААС автономно синтезируются в органах и тканях организма человека (миокард, эндотелий, гладко-мышечные клетки сосудов, почки). Именно активация тканевых РААС играет главную роль в развитии органных поражений при АГ, сахарном диабете (СД). Было сформулировано положение о двухкомпонентной РААС с выделением циркулирующего и локального звеньев, имеющих определенные функциональные различия. Циркулирующее звено РААС обеспечивает кратковременное воздействие на органы-мишени, а повышение активности тканевого звена имеет устойчивый характер и приводит к формированию не только функциональных, но и структурных изменений в органах и тканях. Его активность в тканях остается высокой, даже если концентрация ренина в плазме крови нормализуется (рис. 2). При этом тканевой AТ II стимулирует рост фибробластов, способствует развитию гипертрофии и гиперплазии миокарда, ремоделированию сердца и сосудов, участвует в реакциях клеточного апоптоза. Таким образом, повышение активности РААС, как циркулирующей в крови, так и тканевой, является одним из важнейших патогенетических механизмов формирования АГ, поражения органов-мишеней при сердечно-сосудистых заболеваниях и СД, развитии хронической сердечной недостаточности (ХСН). Ингибиторы АПФ (иАПФ) – это группа лекарственных препаратов, снижающих активность РААС. Первый иАПФ – тепротид был получен в 1971 г. из яда бразильской змеи Jararaca (рис. 3). Но вследствие его токсичности в клинической практике этот препарат почти не применялся. В 1975 г. D. Cushman и M. Ondetti (рис. 4) синтезировали первый пероральный иАПФ – каптоприл, который стал широко использоваться в клинической практике. Началась эра иАПФ. В настоящее время существует более 10 препаратов группы иАПФ, отличающихся друг от друга химической структурой, фармакокинетическими параметрами. Согласно классификации, предложенной в 1994 г. L. Opie [5], все иАПФ разделяются на 3 класса и подгруппы (табл. 1). Липофильные (способные растворяться в жирах) иАПФ (I класс) обычно связываются с белками, обладают фармакологической активностью, метаболизируются в печени с образованием активных и неактивных метаболитов, которые выводятся почками и проникают через гематоэнцефалический барьер. II класс – это пролекарства, которые после гидролиза в печени переходят в активную форму. Препараты III класса не метаболизируются в организме, циркулируют в крови вне связи с белками плазмы и выводятся почками в неизмененном виде. Гидрофильные иАПФ мало связываются с белками, что снижает их биодоступность. Кроме того, иАПФ делятся по продолжительности действия на: – иАПФ короткого действия, которые необходимо назначать 2 или 3 р./сут (например, каптоприл); – иАПФ со средней продолжительностью действия, которые необходимо принимать не менее 2 р./сут (зофеноприл и эналаприл); – иАПФ длительного действия, их принимают 1 р./сут (квинаприл, лизиноприл, периндоприл, рамиприл, спираприл, трандолаприл, фозиноприл). В зависимости от химической структуры выделяют иАПФ, содержащие: – сульфгидрильную группу (каптоприл, зофеноприл и др.); – карбоксиалкильную группу (эналаприл, лизиноприл, периндоприл, рамиприл и др.); – фосфинильную группу (фозиноприл). При этом наличие SH-группы ассоциируется с развитием таких нежелательных эффектов, как гематотоксичность, нарушение вкуса, головная боль. В конце ХХ в. группой исследователей под руководством D. Cushman был синтезирован фозиноприл, отличающийся по своей химической структуре от других иАПФ. Фозиноприл и его активный метаболит фозиноприлат являются пролиновыми производными фосфинильной кислоты. Фосфинильная группа связывается с ионом цинка в активном центре АПФ, ингибируя его активность. Фозиноприл является пролекарством и только после всасывания в тонком кишечнике и гидролиза в печени переходит в активный метаболит – фозиноприлат. Особенностью фозиноприла является то, что его метаболизм осуществляется не только в печени, но и в других органах (слизистой оболочке желудочно-кишечного тракта, почках, сосудах). Период полувыведения препарата составляет от 12 до 15 ч, что позволяет назначать его 1 р./сут. При умеренном нарушении функции почек период полувыведения увеличивается до 14–32 ч, но значимой кумуляции фозиноприла не отмечается. Высокая липофильность фозиноприла обусловливает его широкое распределение в организме, а значит, и его способность ингибировать активность не только циркулирующего в крови АПФ, но и тканевого звена РААС (в сердце, легких, почках, головном мозге). В эксперименте показано, что фозиноприл подавляет активность АПФ в миокарде в большей степени, чем эналаприл, лизиноприл и рамиприл. Основные фармакокинетические параметры фозиноприла существенно не различаются у пациентов молодого и пожилого возраста. Так как препарат имеет 2 основных пути выведения (через почки и с желчью), то при умеренном нарушении функции почек/печени коррекции дозы не требуется [6–8]. Стартовая доза фозиноприла – 10 мг/сут, в т.ч. у пациентов пожилого возраста и при нетяжелом нарушении функции почек и печени. При недостаточном эффекте возможно увеличение дозы до 20–40 мг/сут под контролем АД [9]. Благодаря своим уникальным фармакодинамическим и фармакокинетическим параметрам фозиноприл широко используется при лечении больных с АГ и ХСН, в т.ч. с постинфарктным кардиосклерозом, СД и диастолической дисфункцией миокарда. Результаты контролируемых клинических исследований показали, что фозиноприл в дозе 10–40 мг/сут снижает АД в среднем на 14–29/7–18 мм рт. ст. По данным контролируемых исследований, монотерапия фозиноприлом эффективна у большей части больных с нетяжелой АГ (от 50 до 92%) независимо от расы, пола и при изолированной систолической АГ у пожилых [11]. При однократном приеме фозиноприл эффективно снижает АД в течение суток, в т.ч. и в ранние утренние часы [12]. Нежелательные явления при приеме фозиноприла встречаются редко и, по данным контролируемых клинических исследований, сопоставимы с таковыми в группе плацебо. При приеме фозиноприла не развивается «гипотония первой дозы», что делает его препаратом выбора при лечении больных с ХСН, получающих диуретики. Препарат существенно не влияет на уровень альдостерона, а следовательно, на фоне его приема реже возникает гиперкалиемия. Кашель при приеме фозиноприла встречается значительно реже, чем при лечении другими иАПФ (рис. 5) [10]. Прием фозиноприла, как и всех иАПФ, противопоказан беременным, при наличии стеноза обеих почечных артерий и реакций гиперчувствительности. Применение фозиноприла у больных АГ достоверно снижает частоту развития сердечно-сосудистых событий и смерти от всех причин по сравнению с амлодипином (рис. 6). На фоне длительного (в течение 12 нед.) приема фозиноприла наблюдалось достоверное, по сравнению с группой плацебо, уменьшение гипертрофии миокарда левого желудочка (рис. 7). При сравнении с каптоприлом и лизиноприлом фозиноприл значительно в большей степени ингибирует миокардиальный АПФ, что ведет к более выраженному улучшению как систолической, так и диастолической функций левого желудочка, увеличению ударного и систолического объемов, максимальной скорости изгнания. На фоне терапии фозиноприлом при стабилизации АД на целевом уровне не только не отмечено снижения почечного кровотока и почечной фильтрации – напротив, при длительном его применении эти показатели возрастают. При этом наблюдается снижение уровня протеинурии. Важно, что эти благоприятные изменения наблюдаются и при лечении особенно прогностически неблагоприятной категории пациентов – при сочетании АГ с СД. Фозиноприл, как и другие иАПФ, не оказывает негативного влияния на показатели уровня глюкозы в крови [13, 14]. Есть данные о снижении под влиянием фозиноприла экспрессии Toll-рецепторов у больных АГ с нарушением функции почек. Это может свидетельствовать о противовоспалительном действии препарата, что сопровождается уменьшением эндотелиальной дисфункции и дополнительным нефропротективным действием [15]. Комбинация фозиноприла с антагонистами кальция (амлодипином), диуретиками (гидрохлоротиазидом, индапамидом) потенцирует гипотензивный эффект и хорошо переносится при длительной терапии [16, 17]. У больных с ХСН на фоне терапии фозиноприлом наблюдаются положительная клиническая динамика, повышение толерантности к физической нагрузке, уменьшается потребность в стационарном лечении, улучшаются показатели сократительной функции миокарда. Отмечено снижение смертности больных. При этом эффективность лечения фозиноприлом выше, чем другими иАПФ, в частности эналаприлом (рис. 8). Применение фозиноприла ведет к снижению давления в легочной артерии. Так, в исследовании C. Martiniuc, A. Braniste, T. Braniste (2012) на фоне 2-месячного приема препарата наблюдалось снижение среднего и систолического давления в легочной артерии [19]. Таким образом, иАПФ длительного действия фозиноприл вследствие особенности химической структуры способен ингибировать как циркулирующую, так и тканевую РААС. Фозиноприл не только эффективно снижает АД, но и обладает клинически значимым органопротективным действием, что делает его препаратом выбора при лечении пациентов с АГ и СД. Фозиноприл улучшает клиническое течение ХСН и повышает выживаемость этих пациентов. Терапия фозиноприлом хорошо переносится. Препарат можно использовать у пациентов старших возрастных групп, при нетяжелом нарушении функции почек и печени.
Литература 1. Мареев В.Ю. Блокада ренин-ангиотензин-альдостероновой системы на разных уровнях // Практикующий врач. 2000. № 18. С. 23–24. 2. Schrier R.W., Abraham W.T. Mechanisms of disease: Hormones and hemodynamics in heart failure // New Engl. J. Med. 1999. Vol. 341. № 8. P. 577–585. 3. Сидоренко Б.А., Преображенский Д.В. Диагностика и лечение артериальной гипертензии. Ч. 3. Ингибиторы АПФ и блокаторы АТ1-ангиотензиновых рецепторов. М.: Персид, 2001. 164 с. 4. Dihn D.T., Frauman A.G., Jonston C.I., Fabiani C.I. Angiotensin receptors: distribution, signaling and function // Clinical Sci. 2001. Vol. 100. P. 481–492. 5. Opie L.H. Angiotensin converting enzyme inhibitors. 3th edition. N.Y.: Wiley-Liss, 1999. 6. Сидоренко Б.А., Преображенский Д.В., Батыралиев Т.А. Ингибиторы АПФ и АТ1-ангиотензиновые блокаторы в клинической практике превращающего фермента. Ч. 3. М.: ЗАО «Пресид-Альянс», 2004. 7. Guthrie R. Fosinopril: an overview // Am J Cardiol. 1993. Vol. 72. Р. 22–24. 8. Grover G.J., Sleph P.G., Dzwonczyk S. et al. Effects of different angiotensin-converting enzyme (ACE) inhibitors on ischemic isolated rat hearts: relationship between cardiac ACE inhibition and cardioprotection // J Pharmacol Exp Ther. 1991. Vol. 257. Р. 919–929. 9. Федеральное руководство по использованию лекарственных средств. М., 2013. 10. Martin L.C., Velasco-Cornejro I.F., Franco R.J. Treatment of mild and moderate hypertension with fosinopril. Comparison of adverse effects with other antihypertensive agents // Arq Bras Cardiol. 1994. Vol. 62 (5). Р. 369–374. 11. Pool J.L. Antihypertensive effect of fosinopril, a new angiotensin-converting enzyme inhibitor: Findings on the Fosinopril Study Group II // Clin Ther. 1990. Vol. 12. Р. 520–527. 12. Anderson R.J., Duchin K.L., Gore R.D. et al. Once-daily fosinopril in the treatment of hypertension // Hypertension. 1991. Vol. 17. Р. 636–642. 13. Tatti P., Guarisco R. Pahor M. et al. Outcome results of the Fosinopril Versus Amlodipine Cardiovascular Events Randomized Trial (FACET) in patients with hypertension and NIDDM // Diabetes Care. 1998. Vol. 21 (4). Р. 597–603. 14. Cheung B.M., Lau C.P. Fosinopril reduces left ventricular mass in untreated hypertensive patients: a controlled trial // Br J Clin Pharmacol. 1999 Feb. Vol. 47 (2). Р. 179–187. 15. Tang T.F., Zhou Q.L., Zhu L.L., Tang R., Ao X. Effects of fosinopril and losartan on the expression of Toll-like receptor 4 in renal tubular epithelia cells // Zhong Nan Da, Xue Xue Bao, Yi Xue Ban. 2008 Oct. Vol. 33 (10). Р. 958–965. 16. Meng Y., Zhang Z., Liang X., Wu C., Qi G. Effects of combination therapy with amlodipine and fosinopril administered at different times on blood pressure and circadian blood pressure pattern in patients with essential hypertension // Acta Cardiol. 2010 Jun. Vol. 65 (3). Р. 309–314. 17. Zhang J.L., Qin Y.W., Zheng X., Qiu J.L., Zhao X.X., Zou D.J. Combination therapy with angiotensin-converting enzyme inhibitors and indapamide impairs glucose tolerance in Chinese hypertensive patients // Blood Press. 2010 Apr. Vol. 19 (2).110-8. 18. Blumenthal M. Treatment of congestive heart failure: experience with fosinopril // Am J Hypertens. 1997 Oct. Vol. 10 (10 Pt 2). Р. 289–298. 19. Martiniuc C., Braniste A., Braniste T. Angiotensin converting enzyme inhibitors and pulmonary hypertension // Rev Med Chir Soc Med Nat Iasi. 2012 Oct-Dec.Vol. 116 (4). Р. 1016–1020.
Особые указания по применению препарата Фозиноприл
С осторожностью назначают больным с реноваскулярной гипертензией, сердечной недостаточностью, пациентам, находящимся на гемодиализе, а также больным с гиповолемией и/или пониженной осмолярностью плазмы крови любой этиологии из-за повышенного риска развития у них побочных эффектов со стороны почек. В целях снижения риска развития артериальной гипотензии за 2–3 дня до назначения фозиноприла следует отменить диуретики и провести коррекцию водно-электролитного баланса. У пациентов с гипертрофией левого желудочка длительное применение фозиноприла приводит к снижению массы левого желудочка и уменьшению толщины межжелудочковой перегородки. После отмены фозиноприла синдрома отмены (резкого повышения АД) не наблюдается. Безопасность и эффективность применения фозиноприла в педиатрической практике не установлена. Не требуется специальной коррекции режима дозирования фозиноприла у пациентов пожилого возраста. Женщинам репродуктивного возраста, получающим фозиноприл, следует применять надежные контрацептивные средства.
Фозиноприл, 5 мг, таблетки, 28 шт.
За 2-3 дня до начала лечения фозиноприлом предшествующую терапию диуретиками рекомендуется отменить, за исключением пациентов со злокачественной или трудно поддающейся лечению артериальной гипертензией. В таких случаях терапию фозиноприлом следует начинать немедленно, в сниженной дозе, при тщательном медицинском наблюдении и осторожном увеличении дозы.
Симптоматическая артериальная гипотензия при применении ингибиторов АПФ наиболее часто развивается у пациентов после интенсивного лечения диуретиками, диеты, ограничивающей потребление поваренной соли, или при проведении почечного диализа. Преходящая артериальная гипотензия не является противопоказанием для продолжения лечения после проведения мер по восстановлению ОЦК.
У пациентов с хронической сердечной недостаточностью лечение ингибиторами АПФ может вызывать избыточный антигипертензивный эффект, который может привести к олигурии или азотемии с летальным исходом. Поэтому при лечении фозиноприлом пациентов с хронической сердечной недостаточности необходим тщательный клинический контроль, особенно в течение первых 2 недель лечения, а также при любом увеличении дозы фозиноприла или диуретика.
Ингибиторы АПФ в редких случаях вызывают отек слизистой оболочки кишечника. При этом у пациентов наблюдаются боли в животе (иногда без тошноты и рвоты), отек лица также может отсутствовать, уровень С1-эстераз в норме. После прекращения приема ингибиторов АПФ симптомы исчезают. Отек слизистой оболочки кишечника следует учитывать при дифференциальной диагностике у пациентов с болями в животе на фоне приема ингибиторов АПФ.
На фоне лечения ингибиторами АПФ во время гемодиализа с использованием высокопроницаемых мембран, а также во время афереза ЛПНП с адсорбцией на декстрана сульфат, возможно развитие анафилактических реакций. В этих случаях следует рассмотреть возможность использования диализных мембран другого типа или другой антигипертензивной терапии.
Возможно развитие агранулоцитоза и подавление функции костного мозга во время лечения ингибиторами АПФ. Эти случаи отмечаются чаще у пациентов с нарушением функции почек, особенно при наличии системных заболеваний соединительной ткани (системная красная волчанка или склеродермия). Перед началом терапии ингибиторами АПФ и в процессе лечения проводят определение общего числа лейкоцитов и лейкоцитарной формулы (1 раз в месяц в первые 3-6 месяцев лечения и в первый год лечения у пациентов с повышенным риском нейтропении).
При появлении заметной желтушности и выраженном повышении активности ферментов печени лечением фозиноприл следует отменить и назначить соответствующие лечение.
При артериальной гипертензии у пациентов с двусторонним стенозом почечных артерий или стенозом артерии единственной почки, а также при одновременном применении диуретиков без признаков нарушения функции почек во время лечения ингибиторами АПФ может повышаться концентрация азота мочевины крови и креатинина сыворотки крови. Эти эффекты обычно обратимы и проходят после прекращения лечения. Может потребоваться снижение дозы диуретика и/или фозиноприла.
У пациентов с тяжелой хронической сердечной недостаточностью, с измененной активностью РААС, лечение ингибиторами АПФ может привести к олигурии, прогрессирующей азотемии и, в редких случаях, к острой почечной недостаточности и возможному летальному исходу.
Во время терапии фозиноприлом пациент должен соблюдать осторожность при выполнении физических упражнений или при жаркой погоде из-за риска дегидратации и артериальной гипотензии вследствие уменьшения ОЦК.
Не требуется специальной коррекции режима дозирования фозиноприла у пациентов пожилого возраста. Безопасность применения у детей не установлена.
До и во время лечения препаратом необходим контроль АД, функции почек, содержания калия, содержания гемоглобина, креатинина, мочевины, концентрации электролитов и активности печеночных трансаминаз в крови.
Влияние на способность к вождению автотранспорта и управлению механизмами.
Необходима осторожность при управлении транспортными средствами или выполнении другой работы, требующей повышенного внимания, т.к. возможно головокружение, особенно после начальной дозы фозиноприла.
Фозиноприл-OBL (Fosinopril-OBL)
Артериальная гипотензия
У пациентов с неосложненной формой артериальной гипертензии возможно развитие артериальной гипотензии в связи с применением фозиноприла. Симптоматическая артериальная гипотензия при применении ингибиторов АПФ чаще развивается у пациентов на фоне интенсивного лечения диуретиками, диеты, связанной с ограничением поваренной соли, или при проведении диализа. Транзиторная артериальная гипотензия не является противопоказанием для применения фозиноприла после проведения мер по восстановлению ОЦК.
У пациентов с хронической сердечной недостаточностью лечение ингибиторами АПФ может вызывать избыточный антигипертензивный эффект, который может привести к олигурии или азотемии и в редких случаях к острой почечной недостаточности с летальным исходом. Поэтому при лечении хронической сердечной недостаточности фозиноприлом необходимо внимательно наблюдать за пациентами, особенно на протяжении первых 2 недель лечения, а также при любом увеличении дозы фозиноприла или диуретика.
Может потребоваться снижение дозы диуретика у пациентов с нормальным или низким АД, ранее получавших терапию диуретическими средствами или имеющих гипонатриемию. Артериальная гипотензия как таковая не является противопоказанием для дальнейшего применения фозиноприла при хронической сердечной недостаточности. Некоторое снижение системного АД является обычным и желательным эффектом в начале применения при хронической сердечной недостаточности. Степень этого снижения максимальна на ранних этапах лечения и стабилизируется в пределах одной или двух недель от начала лечения. АД обычно возвращается к исходному уровню без снижения терапевтической эффективности.
Перед началом лечения требуется провести анализ проводившейся ранее гипотензивной терапии, степени повышения АД, ограничения рациона по соли и/или жидкости и других клинических обстоятельств. По возможности следует прекратить проводившуюся ранее гипотензивную терапию за несколько дней до начала лечения. Для уменьшения вероятности возникновения артериальной гипотензии диуретики следует отменить за 2-3 дня до начала лечения. До и во время лечения необходимо контролировать АД, функцию почек, содержание ионов калия, креатинина, мочевины, концентрации электролитов и активность печеночных ферментов в крови.
Аортальный или митральный стеноз/гипертрофическая обструктивная кардиомиопатия Как и все лекарственные средства, обладающие вазодилатирующим действием, ингибиторы АПФ должны с особой осторожностью применяться у пациентов с обструкцией путей оттока крови из левого желудочка.
Нарушение функции почек
У пациентов с артериальной гипертензией с одно- или двусторонним стенозом почечных артерий или стенозом артерии единственной почки во время лечения ингибиторами АПФ может повышаться концентрация азота мочевины крови и креатинина сыворотки крови. Эти эффекты обычно обратимы и проходят после прекращения лечения. Необходим контроль функции почек у таких пациентов в первые недели лечения. У некоторых пациентов повышение концентрации азота мочевины крови и креатинина в сыворотке крови (обычно небольшое и преходящее) может наблюдаться даже без очевидного нарушения функции почек при одновременном применении фозиноприла и диуретиков. Может потребоваться снижение дозы фозиноприла.
У пациентов с тяжелой хронической сердечной недостаточностью функция почек может зависеть от активности ренин-ангиотензин-альдостероновой системы, поэтому лечение ингибиторами АПФ может сопровождаться олигурией и/или прогрессирующей азотемией, и в редких случаях может приводить к острой почечной недостаточности и летальному исходу.
Трансплантация почки
Опыт применения фозиноприла у пациентов, недавно перенесших трансплантацию почки, отсутствует.
Нарушение функции печени
В редких случаях при применении ингибиторов АПФ отмечается синдром, первым проявлением которого является холестатическая желтуха. Затем следует молниеносный некроз печени, иногда с летальным исходом. Механизм развития данного синдрома не изучен. При появлении заметной желтушности и выраженном повышении активности ферментов печени лечение фозиноприлом следует прекратить и назначить соответствующее лечение.
У пациентов с нарушениями функции печени может отмечаться повышенная концентрация фозиноприла в плазме крови. При циррозе печени (в т.ч. алкогольном) кажущийся общий клиренс фозиноприлата снижен, a AUC приблизительно в 2 раза выше, чем у пациентов без нарушений функции печени.
Нейтропения/агранулоцитоз/тромбоцитопения/анемия
Возможно развитие агранулоцитоза и подавление функции костного мозга во время лечения ингибиторами АПФ. Эти случаи отмечаются чаще у пациентов с нарушенной функцией почек, особенно при наличии системных заболеваний соединительной ткани (СКВ или склеродермия). Перед началом терапии ингибиторами АПФ и в процессе лечения проводят определение лейкоцитов и лейкоцитарной формулы (1 раз в месяц в первые 3-6 месяцев лечения и в первый год применения фозиноприла у пациентов с повышенным риском нейтропении).
Реакции гиперчувствительности/ангионевротический отек
Сообщалось о развитии ангионевротического отека конечностей, лица, губ, слизистых оболочек, языка, глотки или гортани у пациентов при применении фозиноприла. При отеке языка, глотки или гортани может развиваться обструкция дыхательных путей с возможным летальным исходом. В подобных случаях необходимо прекращение приема фозиноприла и проведение неотложных мероприятий, включая подкожное введение раствора эпинефрина (адреналина) (1:1000), а также принятие других мер неотложной терапии. В большинстве случаев отека лица, слизистой оболочки ротовой полости, губ и конечностей прекращение приема фозиноприла приводило к нормализации состояния; однако иногда требовалось назначение соответствующей терапии.
Отек слизистой оболочки кишечника
Во время приема ингибиторов АПФ редко отмечался отек слизистой оболочки кишечника. Пациенты жаловались на боли в животе (при этом тошноты и рвоты могло не быть), в некоторых случаях отек слизистой оболочки кишечника возникал без отека лица, активность С1-эстеразы была в норме. Симптомы исчезали после прекращения применения ингибиторов АПФ. Отек слизистой оболочки кишечника должен быть включен в дифференциальную диагностику пациентов, принимающих ингибиторы АПФ, предъявляющих жалобы на абдоминальные боли.
Пациенты, имеющие в анамнезе ангионевротический отек, не связанный с приемом ингибиторов АПФ, могут быть в большей степени подвержены риску развития ангионевротического отека на фоне терапии ингибиторами АПФ.
У представителей негроидной расы случаи развития ангионевротического отека при применении ингибиторов АПФ отмечались с большей частотой по сравнению с представителями других рас.
Увеличение риска развития ангионевротического отека наблюдалось у пациентов, одновременно принимающих ингибиторы АПФ и такие лекарственные средства, как ингибиторы mTOR (темсиролимус, сиролимус, эверолимус), ингибиторы дипептидилпептидазы IV типа (ситаглиптин, саксаглиптин, вилдаглиптин, линаглиптин), эстрамустин, ингибиторы нейтральной эндопептидазы (рацекадотрил, сакубитрил) и тканевые активаторы плазминогена.
Анафилактические реакции во время проведения десенсибилизации
У двух пациентов во время проведения десенсибилизации ядом перепончатокрылых на фоне приема ингибитора АПФ эналаприла были отмечены жизнеугрожающие анафилактоидные реакции. У тех же пациентов данных реакций удалось избежать при помощи своевременного приостановления приема ингибитора АПФ; однако они появились вновь после ненамеренного возобновления приема ингибитора АПФ. Следует проявлять особую осторожность при проведении десенсибилизации пациентов, принимающих ингибиторы АПФ.
Анафилактоидные реакции во время проведения афереза липопротеинов низкой плотности (ЛПНП-афереза)
У пациентов, принимающих ингибиторы АПФ во время проведения ЛПНП-афереза с использованием декстран сульфата, редко наблюдались опасные для жизни анафилактоидные реакции. Развитие данных реакций можно предотвратить, если временно отменять ингибитор АПФ до начала каждой процедуры ЛПНП-афереза.
Гемодиализ с использованием высокопроточных мембран
При проведении гемодиализа у пациентов, получающих ингибиторы АПФ, следует избегать применения высокопроточных полиакрилонитриловых диализных мембран (например, AN69), поскольку в таких случаях повышается риск развития анафилактоидных реакций. В таких случаях необходимо использовать диализные мембраны другого типа или применять гипотензивные средства других классов.
Кашель
При применении ингибиторов АПФ, включая фозиноприл, отмечался непродуктивный, упорный кашель, проходящий после отмены терапии. При появлении кашля у пациентов, принимающих ингибиторы АПФ, следует рассматривать эту терапию как возможную причину в рамках проведения дифференциального диагноза.
Хирургические вмешательства/общая анестезия
Ингибиторы АПФ могут усиливать антигипертензивное действие средств, применяющихся для проведения общей анестезии. Перед хирургическим вмешательством (включая стоматологию) необходимо предупредить врача/анестезиолога о применении ингибиторов АПФ. Следует соблюдать осторожность при выполнении физических упражнений или при жаркой погоде из-за риска дегидратации и артериальной гипотензии вследствие уменьшения ОЦК.
Гиперкалиемия
Отмечались случаи повышения содержания ионов калия в сыворотке крови пациентов, принимающих ингибиторы АПФ, в т.ч. фозиноприл. Группу риска в этом отношении составляют пациенты с почечной недостаточностью, сахарным диабетом 1 типа, а также принимающие калийсберегающие диуретики (такие как спиронолактон, эплеренон, триамтерен или амилорид), препараты калия, калийсодержащие пищевые добавки или другие лекарственные средства, повышающие содержание ионов калия в сыворотке крови. При необходимости одновременного применения фозиноприла и перечисленных выше калийсодержащих или повышающих содержание калия в плазме крови лекарственных средств следует соблюдать осторожность и регулярно контролировать содержание калия в сыворотке крови.
Двойная блокадаренин-ангиотензин-альдостероновой системы (РААС)
Не рекомендуется одновременное применение лекарственных средств различных групп, воздействующих на РААС (двойная блокада РААС), поскольку она ассоциировалась с повышенной частотой развития побочных эффектов, таких как артериальная гипотензия, гиперкалиемия, снижение функции почек (включая острую почечную недостаточность).
Одновременное применение ингибиторов АПФ с препаратами, содержащими алискирен, противопоказано у пациентов с сахарным диабетом и/или с умеренной или тяжелой почечной недостаточностью (СКФ менее 60 мл/мин/1,73 м2 площади поверхности тела) и не рекомендуется у других пациентов.
Одновременное применение ингибиторов АПФ с антагонистами рецепторов ангиотензина II противопоказано у пациентов с диабетической нефропатией и не рекомендуется у других пациентов.
Этнические различия
Ингибиторы АПФ менее эффективны у представителей негроидной расы, чем у пациентов европеоидной расы, что может быть связано с большей распространенностью низкой активности ренина у представителей негроидной расы.